La cataratta è un’opacizzazione o un ispessimento del cristallino. Rappresenta una delle principali cause di cecità nel mondo. Molti fattori possono causare o contribuire alla progressione dell’opacità del cristallino, tra cui malattie oculari, lesioni, interventi chirurgici, malattie sistemiche (ad es. diabete mellito, galattosemia), tossine, luce ultravioletta e quasi ultravioletta, esposizione alle radiazioni e malattie ereditarie.Il deterioramento visivo si verifica con gradi crescenti di gravità e se non trattato può presentarsi come cecità completa. La diagnosi è fatta clinicamente. L’ecografia oculare viene eseguita quando vi è il sospetto di patologia del globo posteriore, ma la valutazione fundoscopica della parte posteriore dell’occhio è oscurata dal cristallino opaco. Il cristallino mostrerà un aumento dello spessore della parete e iperecogenicità.
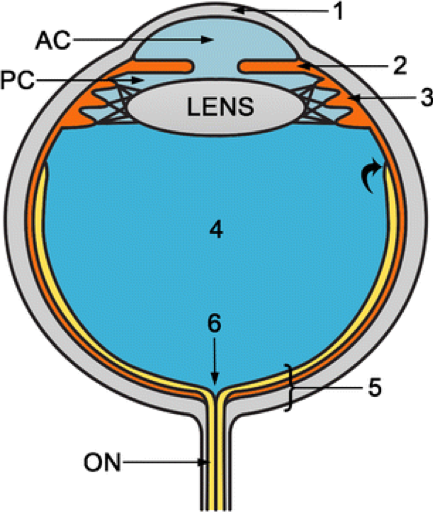
Il segmento anteriore comprende la cornea (1), la camera anteriore (AC), l’iride (2), il corpo ciliare (3), il cristallino e la camera posteriore (PC). AC e PC sono pieni di umore acqueo. Il cristallino è attaccato lateralmente al corpo ciliare. Il segmento posteriore comprende il corpo vitreo (4) e la parete oculare posteriore (5), che è formata da retina, coroide e sclera (complesso RCS posteriore). La camera vitrea è piena di umore vitreo e la sua periferia è chiamata capsula vitrea o ialoide. La retina si ancora anteriormente all’ora serrata (freccia curva) e posteriormente al disco ottico (6). La coroide si ancora anteriormente agli speroni sclerali vicino ai corpi ciliari e posteriormente vicino al forame di uscita delle vene a vortice (a una certa distanza anteriormente al disco ottico). Dietro il globo si vede il nervo ottico (ON).
IL cristallino è colpito da cataratta, il corpo vitreo è chiaro, la retina e il nervo ottico sono piatti.

Occhio normale. La cornea (1) è visualizzata come la linea curva ecogena più superficiale; la camera anteriore (2) è anecogena. L’iride (3) appare come una sottile linea ecogena. Il cristallino (4) è privo di echi e delimitat da echi di confine anteriori e posteriori. Il corpo vitreo (5) contiene una sostanza gelatinosa trasparente normalmente anecogena, sebbene la formazione di macchie ed echi lineari con l’invecchiamento sia considerata normale. Il complesso RCS (6) è la parete del segmento oculare posteriore e appare come una linea concava ecogena che si estende dal piano dell’iride al nervo ottico (ON; 7). ON appare come una banda ipoecogena circondata da grasso retrobulbare ecogeno (8). L’area circolare in cui l’ON si collega alla retina è il disco ottico o la papilla (9)
Occhio normale. La cornea (1) è visualizzata come la linea curva ecogena più superficiale; la camera anteriore (2) è anecogena. L’iride (3) appare come una sottile linea ecogena. Il cristallino (4) è privo di echi e delimitat da echi di confine anteriori e posteriori. Il corpo vitreo (5) contiene una sostanza gelatinosa trasparente normalmente anecogena, sebbene la formazione di macchie ed echi lineari con l’invecchiamento sia considerata normale. Il complesso RCS (6) è la parete del segmento oculare posteriore e appare come una linea concava ecogena che si estende dal piano dell’iride al nervo ottico (ON; 7). ON appare come una banda ipoecogena circondata da grasso retrobulbare ecogeno (8). L’area circolare in cui l’ON si collega alla retina è il disco ottico o la papilla (9).

Un’immagine ecografica di un occhio che mostra una cataratta nel cristallino (c). Sono visibili anche la cornea (a) e i segmenti dell’occhio pieni di liquido/gelatina (b e d).
Cataratta unilaterale in un uomo di 73 anni. Confronta gli echi nel cristallino nell’occhio destro (a) con l’aspetto normale del cristallino nell’occhio sinistro (b)
Le cataratte legate all’età sono strettamente associate all’invecchiamento cronologico del cristallino, all’ossidazione, allo squilibrio del calcio, all’idratazione e alle modificazioni dei cristallini.
I cambiamenti legati all’età nel cristallino causano una riduzione della trasparenza, presbiopia, un aumento della dispersione e dell’aberrazione delle onde luminose e un degrado della qualità ottica dell’occhio.
Prove sempre più numerose indicano che le proteine mal ripiegate sono generate nel reticolo endoplasmatico (ER) dalla maggior parte degli stress catarattogeni della senescenza. L’UPR attiva il fattore 2 correlato al fattore nucleare eritroide-2 (Nrf2), un fattore trascrizionale centrale per la citoprotezione contro lo stress; attiva la mobilizzazione di ER-Ca2+ nel citoplasma, che porta all’attivazione di proteasi Ca2+-dipendenti per scindere vari enzimi e proteine, causando la perdita della normale funzione del cristallino; e migliora la sovrapproduzione di specie reattive dell’ossigeno (ROS), che danneggiano i costituenti del cristallino.
L’eziologia della formazione della cataratta è in ultima analisi correlata all’incapacità di mantenere le normali concentrazioni omeostatiche di Na+, K+ e Ca2+ all’interno del cristallino. Queste anomalie sono apparentemente il risultato di una ridotta attività di Na+, K+-ATPasi,2-7 un difetto solitamente dovuto al danno dei radicali liberi ad alcune delle proteine sulfidriliche nel cristallino, tra cui Na+, K+-ATPasi, che contiene un componente sulfidrilico.
Alla formazione della cataratta, i normali meccanismi protettivi non sono in grado di prevenire i danni dei radicali liberi. Il cristallino, come molti altri tessuti del corpo, dipende da livelli e attività adeguati di superossido dismutasi (SOD), catalasi (CAT) e glutatione (GSH), nonché da livelli adeguati di antiossidanti accessori come la luteina , vitamine E e C e selenio, per aiutare a prevenire i danni causati dai radicali liberi
Il contenuto di SOD, CAT e GSH-perossidasi nel fluido acquoso e nel cristallino diminuisce significativamente con l’aumentare della durezza del nucleo lenticolare, con le lenti al livello di durezza V che hanno il contenuto più basso di antiossidanti.
Gli individui con una maggiore assunzione dietetica di vitamina C ed E, selenio e caroteni (soprattutto luteina) hanno un rischio molto più basso di sviluppare la cataratta. Le vitamine E, B (in particolare la vitamina B12 e l’acido folico) e la vitamina A offrono anch’esse una protezione significativa contro la cataratta nucleare e corticale (Fig. 219.3).10-13
Studi condotti dall’Age-Related Eye Disease Study Research Group e altri indicano che una combinazione di questi nutrienti probabilmente produrrà risultati migliori rispetto a qualsiasi singolo nutriente da solo o anche combinazioni limitate di tre o meno nutrienti nella prevenzione sia della degenerazione maculare senile che della cataratta (vedere il capitolo 195 per ulteriori informazioni).
Luteina
La luteina, il carotene giallo-arancione che offre una protezione significativa contro la degenerazione maculare, esercita anche una protezione contro la formazione di cataratta.14 Come la macula, il cristallino umano concentra la luteina.
US Department of Agriculture, Agricultral Research Service, Nutrient Data Laboratory USDA National Nutrient Database for Standard Reference. [(accessed on 15 March 2016)]; Available online: http://www.ars.usda.gov/ba/bhnrc/ndl
Il corpo umano è in grado di assorbire meglio la luteina salutare per gli occhi dalle uova che da altre fonti alimentari del carotenoide, secondo uno studio finanziato dall’Agricultural Research Service e dall’Egg Nutrition Center di Washington, D.C.
La principale biochimica nutrizionale Elizabeth J. Johnson e colleghi del Carotenoids and Health Laboratory presso il Jean Mayer USDA Human Nutrition Research Center on Aging presso la Tufts University di Boston, Massachusetts, hanno condotto lo studio. I risultati sono riportati nel numero di agosto del Journal of Nutrition.
I ricercatori sospettano che la luteina delle uova sia più facilmente assorbita nel flusso sanguigno rispetto alla luteina di altre fonti a causa dei componenti del tuorlo dell’uovo, come la lecitina.
Un basso apporto di luteina è implicato come fattore di rischio nella degenerazione maculare legata all’età, la principale causa di perdita della vista tra gli americani più anziani. Nell’occhio, la macula si trova nella retina, direttamente dietro la pupilla, ed è responsabile della visione centrale. La luteina e un carotenoide alimentare correlato, la zeaxantina, si accumulano all’interno della macula e impregnano un pigmento giallo che aiuta a proteggere l’occhio.
Dieci volontari, durante quattro diverse fasi del test, hanno consumato spinaci cotti, uova o uno dei due tipi di integratori di luteina. Ogni fonte ha fornito 6 milligrammi (mg) di luteina per dose giornaliera. Johnson ha misurato le concentrazioni di luteina nel siero del sangue dei volontari prima e dopo ogni fase del test. Quando ogni volontario mangiava uova come fonte di luteina, i livelli sierici di luteina nel sangue erano circa tre volte superiori rispetto a dopo aver consumato la stessa dose di luteina dalle altre fonti.
I sondaggi federali riportano che l’americano medio consuma solo circa due mg di luteina al giorno, ma un’insalata di un uovo e una tazza di spinaci raddoppierebbe facilmente fornendo l’equivalente di circa quattro milligrammi di luteina.
Le nuove scoperte suggeriscono che le uova sono una fonte economica di luteina altamente biodisponibile, anche se più di un uovo al giorno fornirebbe quantità di colesterolo alimentare superiori a quelle raccomandate.
La luteina e la zeaxantina (L/Z) sono i carotenoidi predominanti che si accumulano nella retina dell’occhio. L’impatto dell’assunzione di L/Z sul rischio e sulla progressione della degenerazione maculare legata all’età (AMD), una delle principali cause di cecità nel mondo sviluppato, è stato studiato in studi di coorte e sperimentazioni cliniche. Gli studi di coorte hanno generalmente valutato L/Z da fonti alimentari, mentre gli studi clinici si sono concentrati sulla somministrazione di L/Z come integratore. Considerazioni importanti da tenere da valutare in relazione alla dieta L/Z includono: fonti ricche di nutrienti di L/Z, metodi di cottura, varietà dietetiche e uso di grassi sani. I modelli dietetici includono esempi di come i livelli efficaci suggeriti di L/Z possono essere raggiunti attraverso la sola dieta, con valori di 5 mg e 10 mg al giorno descritti. Questi modelli dietetici descrivono una varietà di fonti alimentari, non solo da verdure a foglia verde scura, ma includono anche pistacchi e altre fonti altamente biodisponibili di L/Z come le uova. Questa recensione dei modelli dietetici delineati forniscono informazioni sull’importanza della varietà della dieta tra le persone ad alto rischio di AMD o con segni e sintomi precoci di AMD.
La luteina e la zeaxantina (L/Z) sono due antiossidanti liposolubili appartenenti alla classe dei carotenoidi chiamati xantofille. Insieme al loro isomero di conversione meso-zeaxantina, sono i principali costituenti del pigmento maculare, un composto concentrato nella regione della macula della retina che è responsabile della visione dei dettagli fini. In quanto principale causa di grave compromissione della vista negli australiani di età superiore ai 40 anni, l’AMD continua ad essere un obiettivo importante per lo sviluppo di terapie preventive efficaci per alleviare il carico medico ed economico di questa malattia nel mondo sviluppato.
Recenti articoli di revisione hanno dettagliato le prove che collegano L/Z e AMD con un’enfasi sugli integratori di L/Z, il trasporto e l’immagazzinamento di L/Z nella macula, nonché i potenziali meccanismi di azione che hanno nell’AMD.
Comuni fonti alimentari: verdure e uova. Alcuni fattori ne influenzano l’assorbimento e la biodisponibilità nell’organismo.
C/A 700 carotenoidi sono stati identificati in natura, di cui 20-30 nel sangue e nei tessuti umani, ma nell’occhio si trovano solo luteina e zeaxantina. L/Z (con l’isomero meso-zeaxantina) si accumulano nella retina dell’occhio e formano il pigmento maculare retinico (MP). MP ha diverse funzioni nel migliorare le prestazioni visive e proteggere dagli effetti dannosi della luce, e i livelli di MP sono usati come proxy per la salute maculare, in particolare per prevedere la probabilità di sviluppare AMD]. Nella retina, questi tre composti (luteina, zeaxantina e meso-zeaxantina) mostrano una dominanza regionale con la meso-zeaxantina come carotenoide dominante nell’epicentro, la zeaxantina nella periferia media e la luteina nella periferia della macula.
AMD è una delle principali cause di cecità negli anziani nel mondo sviluppato. AMD aumenta con l’avanzare dell’età e sembra essere più probabile negli uomini rispetto alle donne, anche se questo differisce da paese a paese. La tabella 1 descrive in dettaglio una scala di classificazione clinica per l’AMD. L’AMD precoce è generalmente asintomatica mentre l’AMD tardiva porta alla perdita della visione centrale e alla potenziale cecità.
Sono state dimostrate associazioni sinergiche tra dieta, stile di vita e geni e rischio di AMD, con stili di vita malsani associati a un aumento del rischio di AMD indipendentemente dal genotipo di rischio di AMD.
Numerose misure dietetiche sono state associate al rallentamento della progressione dell’AMD. Questi includono una dieta ricca di acidi grassi omega-3 [18], una dieta con un indice glicemico dietetico inferiore [19,20] e l’assunzione di sostanze nutritive tra cui vitamine C ed E, beta-carotene, zinco, selenio, vitamine del gruppo B, acido folico e vitamina B12 e luteina e zeaxantina.
La loro presenza unica al centro della macula implica un ruolo importante per L/Z nella performance visiva. Si ipotizza che le proprietà antiossidanti e di filtraggio della luce blu di L/Z per lunghezze d’onda corte proteggano l’occhio dall’AMD. La filtrazione della luce blu riduce l’aberrazione cromatica che può migliorare l’acuità visiva e la sensibilità.
La prova di un’associazione tra il consumo di frutta e verdura e il rischio di AMD è stata riportata nel 1988 [26] quando sono stati pubblicati i dati ottenuti dal primo US National Health and Nutrition Examination Survey. In seguito, una serie di studi di coorte e caso-controllo hanno esaminato le associazioni tra l’assunzione dietetica di L/Z e il rischio di AMD.

La variazione è osservata nei risultati degli studi di coorte e caso-controllo disponibili fino ad oggi. Nel complesso, l’evidenza suggerisce un potenziale effetto protettivo del consumo di L/Z, in particolare in relazione alle coorti più giovani, all’AMD tardiva e a quelle ad alto rischio genetico di AMD.

Un’ulteriore prova che l’assunzione di L/Z può fornire protezione contro lo sviluppo dell’AMD proviene dall’Age-Related Eye Disease Study 2 (AREDS2), un importante studio clinico condotto negli Stati Uniti. Nell’originale Age-Related Eye Disease Study (AREDS1), i ricercatori hanno scoperto che l’integrazione con vitamine C (500 mg) ed E (400 UI), β-carotene (15 mg), zinco (80 mg) e rame (2 mg) a livelli ben al di sopra delle DA giornaliere raccomandate ha ridotto il rischio di progressione verso una AMD più avanzata di circa il 25% [23]. Successivamente, AREDS2 ha incorporato luteina (10 mg) e zeaxantina (2 mg) nella formulazione utilizzata nello studio tra le persone con AMD precoce. In un’analisi secondaria, gli integratori L/Z in aggiunta all’integratore AREDS hanno ridotto la progressione verso l’AMD avanzata, sebbene ciò si sia verificato solo in persone con una dieta L/Z bassa. Una riduzione del rischio è stata osservata per gli individui nel quintile 1 che avevano un’assunzione mediana di 696 μg L/Z per 1000 calorie al giorno (intervallo interquartile 552-823 μg/1000 calorie al giorno) con un rapporto di rischio (HR) di 0,74 ( 95% CI, 0,59-0,94) rispetto a nessuna assunzione L/Z. Per quelli con un’assunzione mediana di 1134 μg per 1000 calorie al giorno (intervallo interquartile 1030-1244 μg/1000 calorie al giorno) l’HR era 0,94 (95% CI, 0,74-1,21) dimostrando che il supplemento non ha avuto alcun impatto aggiuntivo sulla progressione della malattia quando la dieta di base era sufficiente in L/Z. Ciò implica che l’assunzione dietetica di almeno 2268 μg di L/Z (con un intervallo di 2060-2488 μg, ipotizzando un apporto energetico giornaliero medio di 2000 calorie) può fornire un certo livello di protezione contro l’AMD tardiva, ma ciò deve
essere confermato in altri studi dietetici di L/Z tra persone con AMD o ad alto rischio di AMD. I risultati complessivi dell’AREDS2 e di altri studi suggeriscono che è probabile che L/Z sia più appropriato e più sicuro del beta-carotene negli integratori originali di tipo AREDS. I risultati indicano anche i potenziali effetti benefici che un apporto dietetico sufficiente di L/Z può avere sulla progressione dell’AMD. La tabella 3 fornisce una sintesi dei risultati dello studio AREDS2.
Le prove suggeriscono anche che una maggiore assunzione di L/Z può proteggere in modo particolare dall’AMD nelle persone con un alto rischio genetico basato su due principali geni dell’AMD. Utilizzando i dati del Blue Mountains Eye Study (BMES) e del Rotterdam Study (RS), tra i partecipanti ad alto rischio genetico, il più alto terzile di assunzione dietetica di L/Z è stato associato a una riduzione di oltre il 20% del rischio di AMD precoce (p = 0,0009). Nessuna associazione simile è stata, tuttavia, trovata per quelli con basso rischio genetico. Questi risultati sono simili a quelli documentati in Ho et al. che è riassunto come parte della Tabella 2.
Sono stati condotti studi controllati randomizzati con supplementi L/Z per valutare come l’integrazione L/Z influisca sulle prestazioni visive in individui con AMD accertata [42-49]. Una meta-analisi di questi sette studi è stata condotta e pubblicata nel 2015 [6]. I risultati di questa meta-analisi suggeriscono che l’integrazione con L/Z è associata a significativi miglioramenti dell’acuità visiva e della sensibilità al contrasto in modo dose-risposta [6]. Inoltre, è stata indicata un’associazione lineare tra questi miglioramenti e l’aumento della densità ottica del pigmento maculare (MPOD).
MPOD, una misura dell’attenuazione della luce blu da parte del pigmento maculare, è linearmente correlata alla quantità di L/Z nella macula. Ruoli e meccanismi precisi non sono completamente compresi; tuttavia, si ritiene che i livelli di MPOD, in particolare nella retina centrale, possano influire sull’AMD.
La maggior parte degli studi ha mostrato una diminuzione dipendente dall’età dei livelli di MPOD e una mancanza di MPOD nell’AMD rispetto ai controlli sani. Una meta-analisi del 2016 di 20 studi randomizzati controllati ha rilevato che l’integrazione di luteina, zeaxantina e meso-zeaxantina migliora l’MPOD sia nei soggetti sani che nei pazienti con AMD in modo dose-risposta. Questi miglioramenti sono stati anche associati positivamente con aumenti dei livelli sierici di L/Z.

Ulteriori ricerche supportano il consumo di fonti alimentari di L/Z per migliorare l’MPOD, in particolare per le persone con basso MPOD al basale. Un esempio di ciò è uno studio su adulti sani che ha confrontato l’effetto di alimenti e integratori ricchi di L/Z su MPOD, nonché marcatori sierologici di attivazione endoteliale, infiammazione e ossidazione. L’intervento di otto settimane [53] che ha utilizzato spinaci in polvere come alimento ricco di L/Z ha riscontrato miglioramenti nell’MPL nei pazienti con risposta sierica più elevata e in quelli con MPL inizialmente basso, a sostegno delle prove osservazionali fino ad oggi. Un altro studio ha mostrato che il consumo di sei uova a settimana aumentava significativamente la concentrazione di carotenoidi maculari (misurati da MPOD) così come i livelli sierici di zeaxantina; tuttavia, i livelli sierici di luteina sono rimasti invariati [54]. Sono necessarie ulteriori prove per accertare meglio in che modo i diversi alimenti contenenti L/Z possono influire sull’MPOD e quali individui trarrebbero beneficio dall’assunzione di L/Z, dato che vi sono prove che suggeriscono che i componenti strutturali responsabili dello stoccaggio e della disponibilità di L/Z nel gli occhi sono geneticamente determinati [50].
Attualmente non ci sono livelli ufficiali di assunzione dietetica raccomandati per L/Z. Tuttavia, sulla base di un articolo pubblicato nel 1994 [31], un’assunzione di 6 mg di L/Z al giorno per uomini e donne è stata suggerita come obiettivo dietetico per ridurre il rischio di degenerazione maculare senile [55]. Tuttavia, le prove provenienti sia dallo studio AREDS2 che dal BMES suggeriscono che livelli di assunzione di L/Z considerevolmente inferiori a 6 mg sono associati a una ridotta probabilità di AMD indicando che livelli inferiori di assunzione potrebbero essere sufficienti a fornire una certa protezione dalla progressione della malattia , sebbene siano necessari ulteriori studi di intervento per accertare un livello target appropriato, in particolare per le persone ad alto rischio di AMD.
I dati sull’assunzione della popolazione L/Z sono limitati, ma le prove attuali suggeriscono che l’assunzione di carotenoidi varia nelle diverse popolazioni e in base alla stagione [56]. Ad esempio, in Europa, l’assunzione giornaliera media dei principali carotenoidi (inclusi retinolo, alfa-tocoferolo, beta-carotene, alfa-carotene, beta-criptoxantina, luteina, zeaxantina e licopene) varia da 3,5 mg/giorno nella popolazione spagnola [57] a 5,33 mg/giorno nella popolazione tedesca[58]. Meno studi hanno misurato in modo specifico il consumo di L/Z nelle popolazioni, sebbene in uno studio americano sugli adulti più anziani, il consumo giornaliero di L/Z fosse di 2,7 mg per gli uomini e 3,09 mg per le donne [59]. In un altro studio, è stato stimato che gli adulti americani consumino circa 1-2 mg di luteina al giorno [60]. In uno studio australiano condotto su adulti più anziani che vivono nelle Blue Mountains, è emerso che l’assunzione media di L/Z era di 0,9 mg e che le donne avevano un’assunzione leggermente superiore rispetto agli uomini [61]. I principali contributori all’assunzione di L/Z sono stati broccoli, fagiolini e arance. Nessun altro studio australiano ha valutato l’assunzione di questi antiossidanti in altri sottogruppi di popolazione; tuttavia, sulla base di questi risultati, le attuali assunzioni negli anziani sono inferiori all’ideale. Nel complesso, i dati disponibili sulle assunzioni attuali suggeriscono che sono notevolmente inferiori all’attuale assunzione suggerita di 6 mg al giorno. Una delle difficoltà nel comprendere e decifrare il ruolo esatto della L/Z dietetica nella prevenzione e/o nella progressione dell’AMD è rappresentata dalle sfide inerenti all’analisi e alla quantificazione del contenuto di L/Z negli alimenti. Fino a poco tempo fa, L/Z venivano misurati insieme perché le procedure analitiche non permettevano la quantificazione separata di questi carotenoidi negli alimenti. Per questo motivo, le tabelle di composizione riportano comunemente il contenuto L/Z degli alimenti come un’unica cifra; tuttavia, sono stati condotti test sui singoli carotenoidi [65] per accertare le diverse quantità dei singoli carotenoidi negli alimenti.

Dato che L/Z si accumula in diverse regioni dell’occhio e contribuisce a diverse funzioni, potrebbe essere importante che entrambi i carotenoidi vengano consumati come parte di un modello dietetico [65]. Una valutazione accurata di L/Z individualmente è cruciale per valutare i loro ruoli relativi nella salute degli occhi [65]. Come mostrato nella Tabella 4, la maggior parte delle fonti vegetali di L/Z contiene solo luteina, mentre il mais e le uova contengono sia luteina che zeaxantina.
Ora si suggerisce anche che la meso-zeaxantina potrebbe non derivare esclusivamente dalla luteina retinica e che potrebbe infatti essere presente in piccole quantità nell’approvvigionamento alimentare. Ad esempio, si dice che la meso-zeaxantina sia comunemente usata nei mangimi per galline in Messico per migliorare la colorazione del tuorlo d’uovo [12]. Questi risultati suggeriscono che potrebbe essere importante quantificare negli alimenti tutti e tre i carotenoidi del pigmento maculare (luteina, zeaxantina e meso-zeaxantina).

Brown, M.J.; Ferruzzi, M.G.; Nguyen, M.L.; Cooper, D.A.; Eldridge, A.L.; Schwartz, S.J.; White, W.S. Carotenoid bioavailability is higher from salads ingested with full-fat than with fat-reduced salad dressings as measured with electrochemical detection. Am. J. Clin. Nutr. 2004, 80, 396–403
Dal punto di vista dell’intera dieta, la disponibilità di carotenoidi da diversi tipi di alimenti, ad esempio verdure, noci e uova, consente un modello dietetico più vario e potenzialmente più facilmente gestibile fornendo quantità maggiori di L/Z. Una preoccupazione per gli interventi dietetici per aumentare i livelli di pigmento maculare è stata la percezione che le quantità di verdure (in particolare verdure a foglia verde come gli spinaci) necessarie per aumentare adeguatamente i livelli di L/Z non siano realistiche; tuttavia, una selezione attenta e mirata di alimenti contenenti L/Z può ancora fornire varietà.
I modelli dietetici che dimostrano questa varietà e l’aspetto dell’assunzione dietetica di L/Z a vari livelli sono delineati nelle Tabelle 6 e 7. Sono stati scelti due livelli target di assunzione di L/Z dato che: (1) il lavoro ha precedentemente suggerito un obiettivo dietetico di 5-6 mg L/Z [31]; e (2) 10 mg rappresenta un livello superiore di ciò che è ottenibile attraverso l’assunzione dietetica ed è vicino al livello L/Z utilizzato nello studio sugli integratori AREDS.
Sebbene i modelli dietetici si basino su questi livelli di assunzione più elevati, le prove degli studi di coorte suggeriscono che un’assunzione dietetica inferiore di circa 2,5 mg potrebbe essere sufficientemente elevata da offrire una certa protezione contro lo sviluppo dell’AMD.

Mentre la quantità totale e la distribuzione di L/Z nell’approvvigionamento alimentare è importante, è anche necessario tenere conto dei fattori che influenzano l’assorbimento e la biodisponibilità di questi carotenoidi. Ad esempio, è stato dimostrato che il consumo di grassi (sotto forma di condimento per insalata, olio da cucina come l’olio extravergine di oliva o uova intere) nello stesso pasto e l’assunzione di carotenoidi (ad esempio, un’insalata di verdure crude o verdure cotte) aumentare efficacemente l’assorbimento di alcuni carotenoidi [67-71].
La biodisponibilità dei carotenoidi può essere ridotta a causa della competizione per l’assorbimento tra i carotenoidi se consumati nello stesso pasto [72]. Inoltre, è stato dimostrato che le fibre alimentari di origine vegetale, come la pectina e la gomma di guar, riducono l’assorbimento dei carotenoidi [73] e la localizzazione dei carotenoidi all’interno dei cloroplasti e dei cromoplasti delle piante può ridurre la biodisponibilità [74]. La ricerca disponibile che studia l’impatto della cottura sui carotenoidi nelle fonti vegetali suggerisce che, sebbene il calore riduca il contenuto di carotenoidi, può comunque aumentare la biodisponibilità dei carotenoidi rispetto alle fonti non cotte [69].
Un esempio particolare di alimento intero in cui la biodisponibilità di L/Z può essere superiore a quella di altre fonti sono le uova. Come si vede nella Tabella 5, la quantità di L/Z nelle uova è considerevolmente inferiore a quella della maggior parte delle verdure contenenti L/Z; tuttavia, la ricerca suggerisce che la biodisponibilità di questi composti dalle uova è superiore rispetto alle fonti vegetali, molto probabilmente a causa del contenuto di grassi [75].
È stato dimostrato che il consumo di un uovo al giorno per cinque settimane aumenta i livelli sierici di luteina del 26% e i livelli di zeaxantina del 38% [76]. Altre ricerche hanno rilevato che l’assunzione giornaliera di tre uova per 12 settimane ha aumentato la luteina sierica e la zeaxantina rispettivamente del 21% e del 48%, in 20 adulti con sindrome metabolica, aumentando il colesterolo HDL plasmatico [77].
Numerosi studi hanno anche valutato la biodisponibilità di L/Z da uova comprese le uova arricchite con quantità maggiori di L/Z rispetto alle uova standard. Uno studio ha mostrato che il consumo di uova arricchite con luteina o zeaxantina o una bevanda a base di latticello d’uovo arricchito con luteina ha aumentato significativamente i livelli sierici di luteina rispettivamente del 76% e del 77% (p <0,001) [78].
Un elevato aumento della concentrazione sierica di zeaxantina è stato osservato anche in individui che ricevevano uova arricchite di zeaxantina: 430% (p < 0,001). Questi aumenti sierici sono paragonabili all’uso quotidiano di integratori da 5 mg [78].
Le prove attuali suggeriscono che è probabile che un’assunzione dietetica più elevata di luteina e zeaxantina svolga un ruolo importante nella protezione contro la degenerazione maculare senile (AMD). Sono necessari miglioramenti nella comprensione e nella quantificazione della luteina e della zeaxantina (L/Z) e della meso-zeaxantina per determinare un target raccomandato per questi carotenoidi maculari, e questo aiuterà anche a comprendere meglio i loro ruoli distinti nella salute degli occhi. Una dieta ricca di una varietà di alimenti è importante per raggiungere livelli dietetici adeguati di L/Z (così come di altri nutrienti). Inoltre, una tale dieta dovrebbe includere molte verdure a foglia verde, in linea con le linee guida dietetiche. C’è anche valore nell’includere una gamma di altri alimenti per aumentare la varietà e migliorare la biodisponibilità di L/Z, come uova e noci selezionate come parte di un modello dietetico sano. Sono giustificati studi di intervento che indagano l’efficacia di modelli dietetici specifici volti ad aumentare il pigmento maculare e prevenire o ritardare la progressione dell’AMD. Nel frattempo, dovrebbe essere incoraggiato il consiglio prudente di aumentare il consumo di alimenti contenenti luteina e zeaxantina nella dieta di quelle persone ad alto rischio di AMD o che hanno già AMD.
Nel 1992 uno studio prospettico di coorte mostrò che il consumo di spinaci (ricchi di luteina) era inversamente correlato al rischio di cataratta abbastanza grave da richiedere l’estrazione. Questa indagine iniziale fu seguita da tre studi prospettici che mostrarono che l’assunzione di luteina era inversamente associata all’estrazione della cataratta (riduzione del rischio dal 20% al 50%). tocoferolo (100 mg) o placebo tre volte a settimana per un massimo di 2 anni. Le prestazioni visive (acuità visiva e sensibilità all’abbagliamento) sono migliorate nel gruppo luteina, mentre c’era una tendenza verso il mantenimento dell’acuità visiva con α- tocoferolo e una diminuzione con l’integrazione con placebo. Gli integratori contenenti luteina si sono dimostrati efficaci nel ridurre l’ossidazione nell’umore acqueo dei pazienti con cataratta senile aumentando l’attività di scavenging del superossido.

Sistemi di difesa antiossidante nel cristallino. L’H2O2 generato dalla dismutazione dell’anione superossido viene degradato da diversi percorsi, tra cui la catalasi, la glutatione perossidasi e la reazione di Fenton. Un rapporto SH/S–S diminuito per ossidazione può essere invertito dalla glutatione reduttasi o dalla glutaredossina 1; quest’ultimo riduce in modo specifico i disolfuri misti proteintiolo. (Da Weikel KA, Garber C, Baburins A, Taylor A. Nutritional modulation of cataract. Nutr. Rev. 2014;72[1]:30–47. PubMed PMID: 24279748.)
Vitamina C
È stato dimostrato che un elevato apporto dietetico di vitamina C da fonti alimentari o integratori protegge dalla formazione di cataratta.10-13,21 Oltre a prevenire la cataratta, i nutrienti antiossidanti come la vitamina C, possono offrire alcuni benefici terapeutici. Diversi studi clinici hanno dimostrato che l’integrazione di vitamina C può arrestare la progressione della cataratta e in alcuni casi migliorare significativamente la vista. Ad esempio, in uno studio condotto nel 1939, 450 pazienti affetti da cataratta iniziarono un programma nutrizionale che includeva 1 g/die di vitamina C, determinando una significativa riduzione dello sviluppo della cataratta.2 Pazienti simili avevano precedentemente richiesto un intervento chirurgico entro 4 anni, ma nei pazienti trattati con vitamina C, solo una manciata necessitava di un intervento chirurgico, e nella maggior parte non c’era evidenza che la cataratta fosse progredita durante il periodo di studio di 11 anni.
Sembra che la dose giornaliera di vitamina C necessaria per aumentare il contenuto di vitamina C del cristallino sia di 1000 mg.
Il cristallino richiede concentrazioni più elevate di vitamina C. Il livello di vitamina C nel sangue è di circa 0,5 mg/dL, mentre quello nelle ghiandole surrenali e pituitarie è 100 volte superiore. Nel fegato, nella milza e nel cristallino, il livello di vitamina C è aumentato di almeno un fattore 20. Affinché queste concentrazioni vengano mantenute, il corpo deve generare enormi quantità di energia per estrarre la vitamina C dal sangue contro questo tremendo gradiente. Mantenere elevate le concentrazioni di vitamina C nel sangue aiuta il corpo a concentrare la vitamina C nei tessuti attivi riducendo il gradiente. Questo è probabilmente il motivo per cui è necessaria una dose così elevata per aumentare il contenuto di vitamina C del cristallino.
In un altro studio, 450 pazienti con cataratta incipiente sono stati avviati con un programma nutrizionale comprendente 1 g/giorno di vitamina C, che ha portato a una significativa riduzione dello sviluppo della cataratta.3
In un ampio studio in doppio cieco, 11.545 medici maschi statunitensi apparentemente sani di età pari o superiore a 50 anni senza una diagnosi di cataratta al basale sono stati assegnati in modo casuale a ricevere 400 UI di vitamina E o placebo a giorni alterni e 500 mg di vitamina C. o placebo giornalmente.22 Dopo 8 anni di trattamento e follow-up, non vi era alcuna differenza significativa nella formazione di cataratta nei gruppi. Questo studio potrebbe non aver mostrato benefici perché era al di sotto della soglia di 1 g/giorno di vitamina C.
Una meta-analisi che riassume le prove degli studi epidemiologici sulla vitamina C e il rischio di cataratta legata all’età ha rilevato che un’assunzione più elevata di vitamina C e l’ascorbato sierico possono essere inversamente associati.23 Il rischio relativo (RR) e l’intervallo di confidenza al 95% ( CI) di cataratta per la categoria più alta rispetto a quella più bassa di assunzione di vitamina C era 0,814 (0,707-0,938) e le associazioni erano significative in America e in Asia. In generale è stata riscontrata un’associazione significativa del rischio di cataratta con la categoria più alta rispetto a quella più bassa di ascorbato sierico (0,704 [0,564–0,879]). Associazioni inverse sono state trovate anche tra ascorbato sierico e cataratta nucleare e cataratta subcapsulare posteriore.

Rappresentazione schematica dei meccanismi d’azione dei vari nutraceutici nella prevenzione della cataratta. (Kaur, A., Gupta, V., Christopher, A.F., Ahmad Malik, M., Bansal, P., (2017). Nutraceuticals in prevention of cataract – An evidence based approach, Saudi Journal of Ophthalmology, 31(1) , 30-37.)
Il NADP è ridotto dall’esoso monofosfato deidrogenas come segue:
NADP+glucosio−6− (P) →NADPH+ribosio5− (P) +CO2
Questa combinazione di scavenging enzimatico e non enzimatico dei radicali liberi è un meccanismo chiave per la protezione del cristallino dal danno fotochimico e da altre forme di danno ossidativo.
Selenio e Vitamina E
Selenio e vitamina E, entrambi antiossidanti, funzionano in sinergia. Il mantenimento di livelli di selenio adeguati sembra essere particolarmente importante perché la glutatione perossidasi della lente umana è selenio-dipendente.
Bassi livelli di selenio favoriscono fortemente la formazione della cataratta. Precedenti studi hanno dimostrato che il contenuto di selenio nel cristallino umano affetto da cataratta è solo il 15% del normale.6
È stato condotto uno studio successivo per esaminare meglio il ruolo del selenio nella formazione della cataratta.
I livelli di selenio nel siero, nel cristallino e nell’umore acqueo sono stati determinati in 48 pazienti con cataratta e confrontati con i livelli nei controlli abbinati. I livelli di selenio nel siero e nell’umore acqueo sono risultati significativamente inferiori nei pazienti con cataratta (siero, 0,28 mg/ml; umore acqueo, 0,19 mg/ml) rispetto ai controlli normali (siero, 0,32 mg/ml; umore acqueo, 0,31mg/mL).
Tuttavia, il livello di selenio nel cristallino stesso non differiva significativamente tra i pazienti con cataratta ei controlli.
La scoperta più importante dello studio è stata la diminuzione del livello di selenio nell’umore acqueo nei pazienti con cataratta. Livelli eccessivi di perossido di idrogeno, fino a 25 volte il normale, si trovano nell’umore acqueo nei pazienti con cataratta. Un eccesso di perossido di idrogeno è associato a una maggiore perossidazione lipidica e a un’alterata permeabilità del cristallino come risultato di un danno alla pompa sodio-potassio.
Questi cambiamenti alla fine lasciano la lente non protetta dai radicali liberi e dai danni del sole. Di conseguenza, si forma una cataratta.
Poiché la glutatione perossidasi dipendente dal selenio è responsabile della scomposizione del perossido di idrogeno, è ovvio che bassi livelli di selenio sono un fattore importante nello sviluppo della cataratta.
Come descritto in precedenza, l’integrazione di vitamina E da sola non rallenta la progressione della formazione della cataratta.19 Uno studio in doppio cieco in cui la vitamina E è stata somministrata a una dose di 500 UI al giorno ha rilevato anche che l’integrazione non ha rallentato la formazione della cataratta.
L’integrazione con vitamina E (400 UI) combinata con vitamina C (500 mg) e beta-carotene (15 mg) non ha avuto alcun effetto sullo sviluppo o sulla progressione della cataratta.25
Tuttavia, una meta-analisi ha indicato che l’assunzione dietetica di vitamina E, l’assunzione dietetica e supplementare di vitamina E e alti livelli di tocoferolo sierico erano significativamente associati a un ridotto rischio di cataratta legata all’età (ARC), 0,86 (IC 95% 0,75, 0,99) e 0,77 (IC 95% 0,66, 0,91), rispettivamente.
I risultati dell’analisi dose-risposta hanno mostrato l’evidenza di un’associazione non lineare tra l’assunzione di vitamina E nella dieta e l’ARC. Il rischio di ARC è diminuito con l’assunzione dietetica di vitamina E da 7 mg/die (rischio relativo = 0,94; 95% CI 0,90, 0,97).
Superossido dismutasi
L’attività della SOD è inferiore nel cristallino umano rispetto ad altri tessuti a causa dei livelli più elevati di ascorbato e glutatione nel cristallino e si riscontra una progressiva diminuzione della SOD nella progressione della cataratta.
L’integrazione orale è probabilmente di scarso valore perché non influenza l’attività della SOD tissutale.27 Di maggior valore è l’integrazione con i cofattori minerali in traccia della SOD, i cui livelli sono notevolmente ridotti nel cristallino catarattoso (rame >90%, manganese 50% e zinco >90%).28
Catalasi
La catalasi è concentrata nella porzione epiteliale del cristallino (superficie anteriore), con livelli molto bassi riscontrati nel resto del cristallino. La sua funzione primaria è quella di ridurre (ad acqua e ossigeno) il perossido di idrogeno formato dall’ossidazione dell’ascorbato.
Tetraidrobiopterina (BH4)
Si ritiene che i composti della pteridina svolgano un ruolo protettivo contro la formazione della cataratta attraverso la prevenzione dell’ossidazione e dei danni causati dalla luce ultravioletta. Questa azione previene la formazione di proteine ad alto peso molecolare nel cristallino. La tetraidrobiopterina funziona come un coenzima essenziale nell’idrossilazione di monoammine come fenilalanina idrossilasi, tirosina idrossilasi e triptofano idrossilasi.
Studi sulla cataratta senile umana hanno dimostrato una riduzione dei livelli degli enzimi che sintetizzano la pteridina e della tetraidrobiopterina.29 L’assunzione di acido folico supplementare può aiutare a compensare questa deficienza.
Vitamine del gruppo B
Si ritiene che la carenza di riboflavina, il precursore del FAD, aumenti la formazione della cataratta deprimendo l’attività del GSH. Sebbene la carenza di riboflavina sia abbastanza comune nella popolazione geriatrica (33%), studi originali che dimostravano un’associazione tra carenza di riboflavina e formazione di cataratta sono stati seguiti da studi che dimostravano l’assenza di tale associazione. Lo stato della riboflavina del paziente può essere determinato misurando l’attività del GSH nei globuli rossi prima e dopo la stimolazione con FAD.31
Sebbene la correzione della carenza sia giustificata, ai pazienti con cataratta non dovrebbero essere prescritti più di 10 mg/die di riboflavina perché è una sostanza fotosensibilizzante: i radicali superossido sono generati dall’interazione di luce, ossigeno ambientale e riboflavina/FAD. La riboflavina e la luce (a livelli fisiologici) sono state utilizzate sperimentalmente per indurre la cataratta.
L’evidenza sembra suggerire che l’eccesso di riboflavina fa più male che bene nei pazienti con cataratta.
L’Age-Related Eye Disease Study (AREDS) ha valutato se l’assunzione dietetica di vitamine del gruppo B è associata alla prevalenza e all’incidenza della cataratta. Nel confronto tra individui con e senza cataratta, quelli con la più alta assunzione di riboflavina rispetto a quelli con la più bassa assunzione avevano le seguenti associazioni: lieve cataratta nucleare-odds ratio (OR), 0,78; Intervallo di confidenza al 95% (CI), da 0,63 a 0,97; cataratta nucleare moderata—OR, 0,62; IC 95%, da 0,43 a 0,90; e lieve cataratta corticale—OR, 0,80; IC 95%, da 0,65 a 0,99. Per B12, i risultati sono stati i seguenti: lieve cataratta nucleare—OR, 0,78; IC 95%, da 0,63 a 0,96; cataratta nucleare moderata—OR, 0,62; IC 95%, da 0,43 a 0,88; e lieve cataratta corticale—OR, 0,77; IC 95%, da 0,63 a 0,95.
La più alta assunzione dietetica di vitamina B6 è stata associata a un ridotto rischio di sviluppo di moderata opacità del cristallino nucleare rispetto al quintile più basso (OR, 0,67; 95% CI, da 0,45 a 0,99).
I più alti livelli di assunzione dietetica di niacina e vitamina B12 erano associati a un ridotto rischio di sviluppo di cataratta nucleare o corticale lieve nei partecipanti che non assumevano multivitaminici.
Aminoacidi
La metionina è un componente dell’enzima antiossidante lenticolare metionina sulfossido reduttasi e un precursore della cisteina, un componente del GSH. La cisteina, insieme agli altri aminoacidi precursori del GSH, ha dimostrato di essere di qualche aiuto nel trattamento della cataratta.33
Zinco, vitamina A e beta-carotene
Gli antiossidanti zinco, vitamina A e beta-carotene sono noti per essere essenziali per la normale integrità epiteliale.
Quantità adeguate di questi nutrienti sono di vitale importanza per la salute della porzione epiteliale del cristallino. In particolare, il beta-carotene può fungere da filtro, proteggendo dai danni indotti dalla luce alla porzione fibrosa del cristallino. Il beta-carotene è il più significativo degli scavenger di radicali liberi dell’ossigeno singoletto ed è utilizzato nel trattamento dei disturbi fotosensibili.34 Tuttavia, in studi a lungo termine, l’integrazione di beta-carotene (50 mg a giorni alterni) da sola non hanno avuto alcun impatto sulla prevenzione della cataratta né nelle donne né negli uomini.
Melatonina
La melatonina è uno scavenger di radicali liberi e antiossidante molto efficiente che può neutralizzare i radicali idrossilici e perossilici e migliorare l’efficienza antiossidante endogena ed esogena.
Nei modelli animali, la MLT è stata un efficace inibitore del danno al DNA, della perossidazione lipidica e della formazione di cataratta.
La melatonina è presente a livelli significativi nel nucleo cellulare, nel citosol acquoso e nelle membrane cellulari ricche di lipidi.
Multivitaminico/minerale
Sono state condotte una revisione sistematica e una meta-analisi per valutare l’efficacia degli integratori multivitaminici/minerali per ridurre il rischio di cataratta legata all’età.38 Sono stati inclusi dodici studi prospettici di coorte e due studi randomizzati controllati (RCT).
I risultati aggregati degli studi di coorte hanno indicato che gli integratori multivitaminici/minerali hanno un effetto benefico significativo nel ridurre il rischio di cataratta nucleare (RR: 0,73; IC 95%: 0,64–0,82), cataratta corticale (RR: 0,81; IC 95%: 0,68 –0,94) e qualsiasi cataratta (RR: 0,66; IC 95%: 0,39–0,93).
Inoltre, non ci sono state riduzioni del rischio di cataratta capsulare posteriore (RR: 0,96; IC 95%: 0,72-1,20) o chirurgia della cataratta (RR: 1,00; IC 95%: 0,92-1,08).
I due RCT hanno dimostrato che gli integratori multivitaminici/minerali potrebbero ridurre il rischio di cataratta nucleare.
Curcumina
Curcuma longa
Yu Jin
La curcumina è stata ampiamente sfruttata per le sue proprietà antinfiammatorie e antiossidanti.
La ricerca indica che la curcumina ha diversi meccanismi anti-cataratta. La curcumina inibisce la perossidazione lipidica della membrana del cristallino, integra e induce l’espressione di enzimi antiossidanti, mantiene l’omeostasi del calcio del cristallino, aiuta le proteine chaperon del cristallino, regola i fattori di trascrizione e modula i livelli dei sistemi enzimatici nel cristallino che sono associati a condizioni patologiche portando alla cataratta.
Lanosterolo
Lanomax
Il lanosterolo è una molecola anfipatica di cui è ricco il cristallino, sintetizzata dalla lanosterolo sintasi.
Le radici genetiche delle cataratte gravi sono state ricondotte a una mutazione del gene che codifica per la lanosterolo sintasi. Il trattamento di cellule che esprimono proteine cristalline disordinate con lanosterolo ha ridotto significativamente gli aggregati proteici preformati in vitro e in esperimenti di trasfezione cellulare, con conseguente solubilizzazione delle cataratte.
Una preparazione di nanoparticelle di lanosterolo quando applicata come collirio a un occhio di un cane con cataratta bilaterale per 6 settimane ha portato a una marcata dissoluzione di quella cataratta, suggerendo che le piccole molecole derivate dalla dieta possono non solo ridurre il rischio di cataratta del cristallino, ma possono anche essere utilizzate nell’inversione terapeutica della cataratta.
Sono necessari studi sull’uomo per verificare questo potenziale trattamento incoraggiante.
https://www.lanomax.com/lanomax.html
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4784074/
Il lanosterolo è uno sterolo. È il composto precursore di tutti gli steroidi. Viene biosintetizzato a partire dallo squalene.
Latticini
La cataratta si sviluppa spesso nei neonati con un deficit omozigote di galattochinasi o di galattosio-1-fosfato uridil transferasi e in animali da laboratorio alimentati con una dieta ad alto contenuto di galattosio. Le anomalie del metabolismo del galattosio possono essere identificate misurando l’attività di questi enzimi nei globuli rossi. È stato suggerito che tali anomalie siano un meccanismo importante in circa il 30% delle cataratte.31 Tuttavia, questo meccanismo di formazione della cataratta sembra essere significativo solo nella formazione della cataratta diabetica e probabilmente non è rilevante per la formazione della cataratta senile.
Metalli tossici
È stato dimostrato che diversi metalli tossici hanno concentrazioni più elevate sia nel cristallino che invecchia che nel cristallino catarattoso. Sebbene i livelli siano più alti in quest’ultimo, il significato di questo risultato è sconosciuto.
La concentrazione di cadmio è da due a tre volte superiore nei cristallini con cataratta rispetto ai controlli della stessa età. Poiché il cadmio sposta lo zinco dal legame nelle proteine enzimatiche legandosi ai gruppi sulfidrilici, può contribuire alla disattivazione dell’estinzione dei radicali liberi e di altri meccanismi di protezione/riparazione.
Il cadmio è un componente comune del fumo di sigaretta che, insieme alla formazione di radicali liberi, può essere la ragione per cui il fumo di sigaretta è associato alle opacità del cristallino. Inoltre, i livelli di nitrito, un metabolita stabile dell’ossido nitrico, sono notevolmente aumentati dal fumo di sigaretta e sono stati trovati in concentrazioni più elevate nei cristallini umani con cataratta.
Altri elementi elevati di significato sconosciuto sono bromo, cobalto, iridio e nickel.

Meccanismi con cui la curcumina protegge l’occhio dalla formazione di cataratta. (Da Raman T, Ramar M, Arumugam M, Nabavi SM, Varsha MK. Meccanismo d’azione citoprotettivo della curcumina contro la cataratta. Pharmacol. Rep. 2016;68[3]:561–569.)
Estratti ricchi di flavonoidi
Sono disponibili diverse scelte eccellenti dal mondo botanico per aiutare con i meccanismi antiossidanti. Tra i migliori ci sono gli estratti ricchi di flavonoidi di Vaccinium myrtillus (mirtillo), Vitis vinifera (semi d’uva) e Pinus maritima (corteccia di pino).
L’insorgenza della cataratta nei ratti può essere ritardata modificando la loro dieta da cibo da laboratorio commerciale a una “dieta ben definita”.
Ricerche preliminari suggeriscono che i componenti flavonoidi nelle diete ben definite possono essere responsabili degli effetti protettivi.
Tra gli estratti ricchi di flavonoidi, gli antocianosidi di mirtillo possono offrire la massima protezione. In uno studio sull’uomo, l’estratto di mirtillo più vitamina E ha fermato la progressione della formazione della cataratta nel 97% di 50 pazienti con cataratta corticale senile.
Hachimijiogan
È stato dimostrato che un’antica formula erboristica cinese, l’Hachimijiogan, aumenta il livello di antiossidanti del cristallino dell’occhio.45 Questa attività può spiegare il suo uso nel trattamento della cataratta per centinaia di anni. Secondo la ricerca clinica, il suo effetto terapeutico è piuttosto impressionante nelle prime fasi della formazione della cataratta. In uno studio, il 60% dei soggetti trattati con Hachimijiogan ha notato un miglioramento significativo, il 20% del gruppo non ha mostrato progressione e solo il restante 20% ha mostrato progressione. Hachimijiogan contiene le seguenti otto erbe (per 24 g):
• Rehmania glutinosa: 6000 mg
• Poria cocos sclerotium: 3000 mg
• Dioscorea opposita: 3000 mg
• Cormus officinalis: 3000 mg
• Epimedium grandiflorum: 3000 mg
• Alisma plantago: 3000 mg
• Astragalus membranaceus: 2000 mg
• Cinnamonum cassia: 1000 mg
Nei casi di compromissione visiva marcata, l’asportazione della cataratta e l’impianto del cristallino possono essere l’unica alternativa. Come con la maggior parte delle malattie, la prevenzione o il trattamento in una fase iniziale è più efficace. Il danno dei radicali liberi sembra essere il fattore principale nell’induzione della cataratta senile, quindi l’evitamento degli agenti ossidanti e la promozione dell’eliminazione dei radicali liberi sono fondamentali per il successo del trattamento. Il paziente deve evitare la luce ultravioletta diretta, la luce intensa e le sostanze fotosensibilizzanti; indossare lenti protettive quando si è all’aperto; e aumentare notevolmente l’assunzione di nutrienti antiossidanti. La progressione del processo patologico può essere arrestata e le lesioni precoci possono essere invertite. Tuttavia, in questo momento non sembra possibile un’inversione significativa delle cataratte ben sviluppate.
Poiché la popolazione geriatrica è particolarmente suscettibile alle carenze nutrizionali, dovrebbe essere fatto ogni sforzo per garantire che il paziente ingerisca e assimili macronutrienti e micronutrienti adeguati.
I pazienti dovrebbero evitare cibi apportatori di radicali liberi e aumentare il consumo di legumi (ricchi di aminoacidi contenenti zolfo), verdure gialle (caroteni) e cibi ricchi di vitamine E e C.
Supplementi
• Formula multivitaminica/multiminerale ad alta potenza
• Luteina: da 5 a 15 mg/die
• Vitamina C: 1 g da una a tre volte al giorno
• Vitamina E: da 600 a 800 UI/die
• Selenio: 400 mcg/giorno
• l-Cisteina o N-acetilcisteina: 400 mg/die
• l-Glutammina: 200 mg/giorno
• l-Glicina: 200 mg/die
Medicinali botanici
• Estratto di mirtillo (25% contenuto di antocianidine): 80 mg tre volte al giorno
• Formula Hachimijiogan: 1000 mg tre volte al giorno
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9311900/pdf/antioxidants-11-01285.pdf
Le principali cause della formazione della cataratta sono i radicali liberi, normalmente neutralizzati dalla presenza di antiossidanti endogeni nell’occhio. Utilizzando xenobiotici, è stato confermato che i radicali liberi mediano la formazione della cataratta.
Sono stati sviluppati due modelli di cataratta, il modello di selenite e il modello di cataratta diabetica, per studiare la fisiopatologia della formazione di cataratta dovuta ai radicali liberi e il ruolo degli antiossidanti durante il processo di catarattogenesi.
Composti naturali con proprietà antiossidanti potrebbero effettivamente essere applicati come strategia di intervento su larga scala e sono anche relativamente poco costosi. Alcune piante con proprietà antiossidanti hanno anche proprietà anti catarattogenesi: per curcuma, vitamina C e vitamina E, esistono molti dati che mostrano attività anti-cataratta e antiossidanti.
Questi antiossidanti possono essere integrati nella dieta per una migliore difesa contro i radicali liberi. Gli studi sulla vitamina C e sulla vitamina E hanno dimostrato che sono in grado di prevenire la perossidazione lipidica, impedendo così la generazione di radicali liberi, ma la loro efficacia come agente anti-cataratta è discutibile.
Lenti sporche = panorama appannato.
A differenza delle vitamine C ed E, la curcumina è ben consolidata come agente anti-cataratta, ma la questione della biodisponibilità della curcumina deve ancora essere affrontata.
La nanotecnologia si rivela un’area promettente per aumentare la biodisponibilità della curcumina, ma sono necessarie ancora molte ricerche prima dell’uso della curcumina come efficace agente anti-cataratta per gli esseri umani.
La cataratta è una condizione che causa cecità a 17 milioni di persone ed è la causa più significativa di perdita della vista, circa il 47,9%.

La formazione della cataratta è legata sia alla produzione di specie reattive dell’ossigeno (ROS) sia alla riduzione di antiossidanti endogeni. I ROS sono molecole altamente reattive prodotte dall’ossigeno. Esempi di ROS includono perossidi, superossidi e radicali idrossilici. I ROS sono prodotti nelle risposte cellulari agli xenobiotici e all’invasione batterica e durante il metabolismo ossidativo mitocondriale. Un ROS eccessivo può innescare lo stress ossidativo che avvia la progressione delle opacità del cristallino. I ROS e altri radicali liberi sono molecole altamente reattive perché i loro orbitali esterni hanno uno o più elettroni spaiati e possono essere neutralizzati da composti donatori di elettroni, come gli antiossidanti. Esempi di composti antiossidanti naturali sono la vitamina C, la vitamina E e il beta-carotene. Numerosi studi hanno dimostrato che le piante contengono numerosi composti antiossidanti che possono essere usati come preventivi o inibitori della cataratta. Gli estratti antiossidanti naturali per la terapia della cataratta possono essere ulteriormente studiati alla luce di questi risultati, che dimostrano che il consumo di una quantità sufficiente di piante ricche di antiossidanti è un approccio eccellente alla prevenzione della cataratta.
Diversi altri composti naturali prevengono anche la cataratta inibendo l’aldoso reduttasi e prevenendo l’apoptosi del cristallino.


Produzione di radicali liberi tramite reazione di Fenton, adattato da Coleman (2010).

Produzione di radicali liberi tramite reazione di Fenton, adattato da Coleman (2010).


Antiossidanti naturali come possibili inibitori dell’aldoso reduttasi (AR: un enzima chiave implicato Figura 7. Antiossidanti naturali come possibili inibitori dell’aldoso reduttasi (AR: un enzima chiave implicato nella catarattogenesi
Troppo zucchero annebbia la vista, provocando la cataratta. Il cristallino è paragonabile al vetro di una finestra. Se il vetro è limpido è possibile ammirare il panorama in modo nitido. Quando il vetro è sporco, il panorama appare offuscato.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8835903/pdf/ijms-23-01255.pdf
