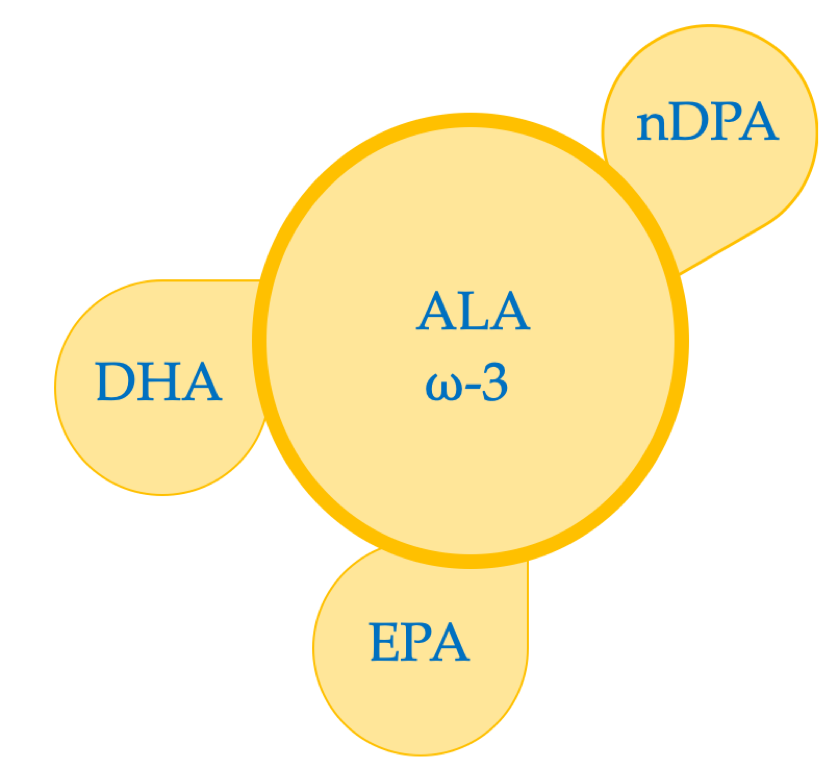
I PUFA sono acidi grassi poli insaturi (polyunsatured fatty acids) dotate di rilevanza speciale nello stato di salute generale, a causa della particolarità di dare origine a determinati mediatori lipidici biologicamente attivi che agiscono come potenti regolatori intracellulari, svolgendo ruoli chiave nei processi infiammatori e nelle risposte immunitarie. I PUFA comprendono:
I PUFA a corta catena:
Acido linoleico (LA): omega-6
Acido alfa-linolenico (ALA): omega-3
Acido arachidonico: omega-6
I PUFA a lunga catena (LCPUFA)
Acido docosaesaenoico: DHA (omega-3)
acido eicosapentaenoico: EPA: (omega-3)
acido docosapentaenoico (DPA): (omega-3)
Il DHA svolge un ruolo chiave per la salute e per la prevenzione delle malattie. E’ un acido grasso polinsaturo a catena lunga (LCPUFA) appartenente alla serie omega-3 (ω3) degli acidi grassi polinsaturi (PUFA), insieme all’acido eicosapentaenoico (EPA) e all’acido docosapentaenoico (DPA). Questi possono essere consumati direttamente con la dieta o sintetizzati dall’acido α-linolenico (ALA), un PUFA omega-3), un nutriente essenziale (deve essere introdotto con la dieta, non potendo essere sintetizzato dal corpo). Oltre alla serie omega-3, i PUFA includono anche la serie degli acidi grassi omega-6 (ω6), che comprende, tra gli altri, un altro acido grasso essenziale, l’acido linoleico (LA), e il suo principale prodotto LCPUFA, l’acido arachidonico (AA ), che può essere ottenuto attraverso la dieta.
Tuttavia, affinché questi processi avvengano correttamente, il mantenimento di un adeguato equilibrio tra l’assunzione di PUFA omega-3 e omega-6, è un fattore chiave. Infatti, gli omega-6 e 3 sono in competizione nelle vie metaboliche coinvolte nella sintesi di quei mediatori lipidici bioattivi.
A causa della scarsità di omega-3 nella dieta moderna e dell’eccessivo apporto di acidi grassi omega-6, c’è uno squilibrio che si traduce in condizioni altamente infiammatorie nell’uomo moderno. Questo squilibrio riveste un ruolo importante nelle malattie degenerative con una base infiammatoria nell’uomo moderno. L’indice di omega-3 è la percentuale combinata di EPA e DHA degli acidi grassi totali nella membrana dei globuli rossi.

EFSA Panel on Dietetic Products, Nutrition, and Allergies. Scientific opinion on dietary reference values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. EFSA J. 2010, 8, 1461Vie metaboliche subite dagli acidi grassi polinsaturi omega-6 e omega-3 (PUFA) come precursori di eicosanoidi (in blu) e mediatori lipidici pro-risolutivi specializzati (SPM, in verde). COX: cicloossigenasi; LOX: lipossigenasi.
Calder, P.C. n-3 Polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am. J. Clin. Nutr. 2006, 83, 1505S–1519S.
I due acidi grassi essenziali, LA e ALA, danno origine ai rispettivi LCPUFA lungo una via metabolica simile, in cui sono condivisi gli enzimi di desaturazione e allungamento. Sebbene LCPUFA possa essere consumati anche nella dieta, le trasformazioni finali che portano alla formazione di mediatori lipidici attivi dipenderanno dalla competizione enzimatica, perché oltre agli enzimi sopra menzionati, entrambe le serie competono ulteriormente anche per le cicloossigenasi (COX) e le lipossigenasi (LOX) portando alla formazione di eicosanoidi (prostaglandine e leucotrieni).
Calder, P.C. n-3 Polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am. J. Clin. Nutr. 2006, 83, 1505S–1519S.
In particolare, gli omega-6 AA daranno origine a potenti eicosanoidi infiammatori e proaggreganti chiamati prostaglandine di serie 2 (PG2) e leucotrieni di serie 4 (LT4).
Wiktorowska-Owczarek, A.; Berezińska, M.; Nowak, J.Z. PUFAs: Structures, Metabolism and Functions. Adv. Clin. Exp. Med. 2015, 24, 931–941.
E sebbene i PUFA omega-6 siano stati tradizionalmente considerati composti pro-infiammatori, l’acido diomo-γ-linolenico (DGLA), un altro LCPUFA omega-6, è il precursore delle prostaglandine di serie 1, che hanno dimostrato di avere effetti anti infiammatori, vasodilatatori e antiipertensivi.
Sergeant, S.; Rahbar, E.; Chilton, F.H. Gamma-linolenic acid, Dihommo-gamma linolenic, Eicosanoids and Inflammatory Processes. Eur. J. Pharmacol. 2016, 785, 77–86
Dalla serie degli omega-3, in particolare dall’EPA, derivano le prostaglandine di serie 3 e i leucotrieni di serie 5 con funzioni antinfiammatorie, antiaggreganti e vasodilatatrici [3].
Wiktorowska-Owczarek, A.; Berezińska, M.; Nowak, J.Z. PUFAs: Structures, Metabolism and Functions. Adv. Clin. Exp. Med. 2015, 24, 931–941
Gli enzimi LOX consentiranno anche la sintesi dei cosiddetti mediatori lipidici pro-risolventi specializzati (SPM), che aiutano ulteriormente a risolvere il processo infiammatorio [5].
Serhan, C.N. Novel lipid mediators and resolution mechanisms in acute inflammation: To resolve or not? Am. J. Pathol. 2010, 177, 1576–1591
Gli SPM più noti derivano dalla serie omega-3 LCPUFA, come le resolvine della serie E, derivate da EPA; resolvine, protettine e maresine della serie D, che si formano da DHA; e Lipoxine, da DPA. Le serie Omega-6 sono anche coinvolte nella risoluzione dell’infiammazione, poiché altri SPM chiamati lipoxine sono formati da AA.
Wiktorowska-Owczarek, A.; Berezińska, M.; Nowak, J.Z. PUFAs: Structures, Metabolism and Functions. Adv. Clin. Exp. Med. 2015, 24, 931–941
Poiché entrambe le serie dipendono dalla competizione enzimatica, la concentrazione nella membrana cellulare dei suoi precursori determinerà i livelli relativi dei prodotti formati. È ben noto che le diete di tipo occidentale tendono a includere una quantità insufficiente di omega-3, mentre l’assunzione di omega-6 tende ad essere superiore a quella raccomandata e, di conseguenza, le membrane cellulari contengono solitamente quantità più elevate di AA .
Calder, P.C. n-3 Polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am. J. Clin. Nutr. 2006, 83, 1505S–1519S.
Pertanto, l’ottimizzazione del rapporto omega 6:3 nella dieta consente di fornire più EPA e DHA per modulare la formazione di eicosanoidi e ridurre lo stato di infiammazione cronica di basso grado associato a una gamma crescente di malattie croniche.
Calder, P.C. n-3 Polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am. J. Clin. Nutr. 2006, 83, 1505S–1519S.
In effetti, i modelli alimentari più sani, misurati dall’Healthy Eating Index (HEI), sono associati a rapporti omega-6/omega-3 più bassi e l’aderenza alla dieta mediterranea ha una correlazione con le concentrazioni di AA nella membrana dei globuli rossi, EPA e DHA.
Sheppard, K.W.; Cheatham, C.L. Omega-6/omega-3 fatty acid intake of children and older adults in the US: Dietary intake in comparison to current dietary recommendations and the Healthy Eating Index. Lipids Health Dis. 2018, 17, 1–12.
auregibeitia, I.; Portune, K.; Rica, I.; Tueros, I.; Velasco, O.; Grau, G.; Trebolazabala, N.; Castaño, L.; Larocca, A.V.; Ferreri, C.; et al. Fatty Acid Profile of Mature Red Blood Cell Membranes and Dietary Intake as a New Approach to Characterize Children with Overweight and Obesity. Nutrients 2020, 12, 3446.
Va tenuta presente la molto limitata conversione metabolica dell’ALA alimentare in EPA e soprattutto in DHA, che potrebbe essere insufficiente per sostenere una salute ottimale in porzioni significative della popolazione, in particolare coloro che escludono pesce e molluschi dalla loro dieta.
Burdge, G.C.; Calder, P.C. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod. Nutr. Dev. 2005, 45, 581–597.
È interessante notare che il tasso di conversione in DHA è maggiore nelle donne ed è ulteriormente regolato durante la gravidanza, presumibilmente a causa di fattori ormonali. Tuttavia, i tassi di conversione sarebbero ancora minimi, con l’integrazione di donne in gravidanza con ALA che non riesce a fornire un aumento dei livelli ematici di DHA nel cordone ombelicale].
De Groot, R.H.; Hornstra, G.; van Houwelingen, A.C.; Roumen, F. Effect of alpha-linolenic acid supplementation during pregnancy on maternal and neonatal polyunsaturated fatty acid status and pregnancy outcome. Am. J. Clin. Nutr. 2004, 79, 251–260.
Al contrario, l’integrazione di donne in gravidanza con olio di pesce, ricco di DHA, ha aumentato i livelli ematici del cordone ombelicale e i livelli plasmatici infantili di DHA alla nascita [10].
Van Houwelingen, A.C.; Sørensen, J.D.; Hornstra, G.; Simonis, M.M.; Boris, J.; Olsen, S.F.; Secher, N.J. Essential fatty acid status in neonates after fish-oil supplementation during late pregnancy. Br. J. Nutr. 1995, 74, 723–731.
Infine, il DHA dietetico materno ha un forte effetto dose-dipendente sulla concentrazione di DHA nel latte materno.
Makrides, M.; Neumann, M.A.; Gibson, R.A. Effect of maternal docosahexaenoic acid (DHA) supplementation on breast milk composition. Eur. J. Clin. Nutr. 1996, 50, 352–357.
I PUFA sono costituenti delle membrane cellulari, determinandone in modo significativo la fluidità e la funzione, e all’interno delle particelle di lipoproteine plasmatiche, i PUFA sono anche i principali costituenti di fosfolipidi, trigliceridi ed esteri del colesterolo. Inoltre, fungono da precursori di metaboliti bioattivi che agiranno come messaggeri secondari e mediano funzioni quali risposte infiammatorie, aggregazione piastrinica e tono vascolare [12].
Gramlich, L.; Ireton-Jones, C.; Miles, J.M.; Morrison, M.; Pontes-Arruda, A. Essential Fatty Acid Requirements and Intravenous Lipid Emulsions. JPEN J. Parenter. Enter. Nutr. 2019, 43, 697–707.
Tra i PUFA, omega-6 LA e omega-3 ALA sono gli unici acidi grassi essenziali, perché sono nutrienti che devono essere introdotti con la dieta a causa della nostra incapacità di sintetizzarli. Da un punto di vista fisiologico, LA e ALA sono anche nutrienti essenziali richiesti per la crescita, lo sviluppo e il normale funzionamento.
Ciò è dimostrato dagli effetti delle loro carenze, che costituiscono un’entità patologica nota come carenza di acidi grassi essenziali (EFAD). Le manifestazioni di EFAD includono iperlipidemia, trombocitopenia, aggregazione piastrinica alterata ed enzimi epatici elevati, nonché altri segni clinici come aumento della suscettibilità alle infezioni, crescita ridotta nei neonati e nei bambini, compromissione della guarigione delle ferite, eruzione cutanea squamosa secca o perdita di capelli [12].
Gramlich, L.; Ireton-Jones, C.; Miles, J.M.; Morrison, M.; Pontes-Arruda, A. Essential Fatty Acid Requirements and Intravenous Lipid Emulsions. JPEN J. Parenter. Enter. Nutr. 2019, 43, 697–707.
L’EFAD è relativamente rara, poiché si stima che l’assunzione sufficiente per prevenire questa situazione sia pari al 2%-4% dell’apporto energetico totale per LA e allo 0,25%-0,5% per ALA, ma può verificarsi in individui che limitano gravemente l’assunzione di grassi.
FAO Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010
Tuttavia, il tasso di conversione limitato e ampiamente variabile di ALA in DHA ha portato a un crescente riconoscimento di questo nutriente come acido grasso essenziale condizionale.
Le, H.D.; Meisel, J.A.; de Meijer, V.E.; Gura, K.M.; Puder, M. The essentiality of arachidonic acid and docosahexaenoic acid. Prostaglandins Leukot. Essent. Fatty Acids 2009, 81, 165–170.
Infatti, il DHA svolge un ruolo cruciale in diverse fasi della vita: nei neonati il DHA è ritenuto fondamentale per la crescita e lo sviluppo funzionale del cervello, così come per il mantenimento della normale funzione cerebrale negli adulti [15].
Horrocks, L.A.; Yeo, Y.K. Health benefits of docosahexaenoic acid (DHA). Pharmacol. Res. 1999, 40, 211–225.
I tessuti cerebrali (principalmente la materia grigia) e l’occhio contengono proporzioni più elevate di DHA rispetto ad altri organi [16], poiché è coinvolto nella segnalazione neuronale e nella funzione visiva [17].
O’Brien, J.S.; Sampson, E.L. Fatty acid and fatty aldehyde composition of the major brain lipids in normal human gray matter, white matter, and myelin. J. Lipid Res. 1965, 6, 545–55.
Anderson, R.E. Lipids of ocular tissues: IV. A comparison of the phospholipids from the retina of six mammalian species. Exp. Eye Res. 1970, 10, 339–344
Mentre il mantenimento della concentrazione di DHA è vitale durante l’intero corso della vita, in particolare la gravidanza, l’allattamento e l’infanzia sono periodi particolarmente vulnerabili, in cui il ruolo del DHA nei primi 100 giorni di vita è quindi di grande importanza per il successivo sviluppo fetale ottimale. E’ necessaria anche una adeguata assunzione nel neonato.
FAO Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010
A questo proposito, gli studi dimostrano che l’integrazione con EPA e/o DHA può ridurre le complicanze della gravidanza e favorire diversi esiti materni e neonatali, con un effetto antinfiammatorio sulla placenta [18,19,20].
Jones, M.L.; Mark, P.J.; Waddell, B.J. Maternal dietary omega-3 fatty acids and placental function. Reproduction 2014, 147, R143–R152.
Middleton, P.; Gomersall, J.C.; Gould, J.F.; Shepherd, E.; Olsen, S.F.; Makrides, M. Omega-3 fatty acid addition during pregnancy. Cochrane Database Syst. Rev. 2018,
Keelan, J.A.; Mas, E.; D’Vaz, N.; Dunstan, J.A.; Li, S.; Barden, A.E.; Mark, P.J.; Waddell, B.J.; Prescott, S.L.; Mori, T.A. Effects of maternal n-3 fatty acid supplementation on placental cytokines, pro-resolving lipid mediators and their precursors. Reproduction 2015, 149, 171–178
Inoltre, nello studio di Tahaei et al. [21], con dati prospettici di 2644 donne spagnole in stato di gravidanza. Rispetto ai partecipanti nel quartile più basso (<1,262 g/giorno) di consumo di PUFA omega-3 durante il primo trimestre, i bambini le cui madri erano nel quartile più alto (>1,657 g/giorno) avevano un punteggio cognitivo generale più alto.
Tahaei, H.; Gignac, F.; Pinar, A.; Fernandez-Barrés, S.; Romaguera, D.; Vioque, J.; Santa-Marina, L.; Subiza-Pérez, M.; Llop, S.; Soler-Blasco, R.; et al. Omega-3 Fatty Acid Intake during Pregnancy and Child Neuropsychological Development: A Multi-Centre Population-Based Birth Cohort Study in Spain. Nutrients 2022, 14, 518.
Inoltre, il profilo degli acidi grassi della dieta è un noto determinante del rischio cardiovascolare, dove la riduzione del contributo degli acidi grassi saturi e dei grassi totali, aumentando l’assunzione di PUFA, assumendo olio di pesce, aiuta a ridurre questo rischio [1].
EFSA Panel on Dietetic Products, Nutrition, and Allergies. Scientific opinion on dietary reference values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. EFSA J. 2010, 8, 1461.
La meta-analisi condotta da He et al. su studi di coorte hanno indicato che ogni aumento giornaliero di 20 g nell’assunzione di pesce era associato a un rischio inferiore del 7% di mortalità dovuta a malattia coronarica (CHD). Conclusioni comparabili sono state ottenute per l’ictus come endpoint. Un’altra recente meta-analisi di Harris et al. hanno mostrato una continua e significativa relazione dose-risposta per l’assunzione combinata di EPA e DHA (fino a 0,5 g/die) e il rischio di morte correlata a malattia coronarica.
He, K.; Song, Y.; Daviglus, M.L.; Liu, K.; Van Horn, L.; Dyer, A.R.; Greenland, P. Accumulated evidence on fish consumption and coronary heart disease mortality: A meta-analysis of cohort studies. Circulation 2004, 109, 2705–2711.
Harris, W.S.; Kris-Etherton, P.M.; Harris, K.A. Intakes of long-chain omega-3 fatty acid associated with reduced risk for death from coronary heart disease in healthy adults. Curr. Atheroscler. Rep. 2008, 10, 503–509.
Infine, le prove esistenti da studi osservazionali trasversali e prospettici indicano un’associazione inversa tra l’assunzione dietetica e supplementare di PUFA omega-3 e il rischio di declino cognitivo, demenza e malattia di Alzheimer [24,25].
Lim, W.S.; Gammack, J.K.; Van Niekerk, J.; Dangour, A.D. Omega 3 fatty acid for the prevention of dementia. Cochrane Database Syst. Rev. 2006, 1, cd005379
ssa, A.M.; Mojica, W.A.; Morton, S.C.; Traina, S.; Newberry, S.J.; Hilton, L.G.; Garland, R.H.; Maclean, C.H. The efficacy of omega–3 fatty acids on cognitive function in aging and dementia: A systematic review. Dement. Geriatr. Cogn. Disord. 2006, 21, 88–96.
Diverse revisioni sistematiche su studi osservazionali e studi clinici confermerebbero l’effetto positivo degli acidi grassi omega-3, in particolare il DHA, sulla cognizione, principalmente nelle funzioni di memoria, degli adulti più anziani [26,27].
Yurko-Mauro, K.; Alexander, D.D.; Van Elswyk, M.E. Docosahexaenoic acid and adult memory: A systematic review and meta-analysis. PLoS ONE 2015, 10, e0120391.
Zhang, X.W.; Zhang, X.W.; Hou, W.S.; Li, M.; Tang, Z.Y. Omega-3 fatty acids and risk of cognitive decline in the elderly: A meta-analysis of randomized controlled trials. Aging Clin. Exp. Res. 2016, 28, 165–166.
Ad ogni modo, sono necessari ulteriori studi clinici di intervento a lungo termine per valutare il ruolo degli acidi grassi omega-3 e per accertare quale dosaggio e durata della supplementazione dovrebbero essere più efficienti.
Gli obiettivi nutrizionali stabiliti dalla comunità della Società spagnola di Nutrizione (SENC) per quanto riguarda i PUFA totale, sono fissati al 4% dell’energia totale (TE), in particolare all’1-2% TE per gli acidi grassi omega-3, inclusi 0,2 g/giorno di DHA e la combinazione di EPA + DHA a 0,5-1 g/giorno. Le cifre proposte sono adattate alle abitudini di consumo di pesce della popolazione spagnola, considerando un’assunzione media di pesce di una porzione a settimana e 2 porzioni a settimana per il 75 ° percentile.
Bartrina, J.A.; Majem, L.S. Objetivos nutricionales para la población española: Consenso de la Sociedad Española de Nutrición Comunitaria 2011. Span. J. Community Nutr. 2011, 17, 178–199.
Tuttavia, la SENC non dettaglia le raccomandazioni per gruppi di popolazione specifici, così come l’Autorità europea della sicurezza alimentare (EFSA). Per le donne in gravidanza o che allattano, l’assunzione adeguata (AI) aggiunge 0,1-0,2 g/giorno di DHA preformato a quello degli adulti, fissato a 0,25 g/giorno per EPA + DHA.
EFSA Panel on Dietetic Products, Nutrition, and Allergies. Scientific opinion on dietary reference values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. EFSA J. 2010, 8, 1461
Per i bambini, viene proposta un adeguate intake di 0,1 g/giorno di DHA (tra 6 e 24 mesi), poiché i livelli di assunzione tra 0,05-0,1 g/giorno sono stati trovati efficaci per la funzione visiva durante il periodo di alimentazione complementare. Per il periodo di età da 2 a 18 anni, l’EFSA afferma solo che le raccomandazioni dietetiche per i bambini dovrebbero essere coerenti con quelle degli adulti.
EFSA Panel on Dietetic Products, Nutrition, and Allergies. Scientific opinion on dietary reference values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. EFSA J. 2010, 8, 1461
Secondo le raccomandazioni stabilite dall’Organizzazione per l’alimentazione e l’agricoltura dell’Organizzazione delle Nazioni Unite/World Health (FAO/OMS) del 2008 [13], il contributo del PUFA dovrebbe variano tra il 6-11% TE, con acidi grassi omega-3 tra 0,5-2% TE e EPA + DHA a 0,25-2 g/giorno. Per le femmine in gravidanza e in allattamento per adulti, l’assunzione minima che mira alla salute ottimale degli adulti e allo sviluppo fetale e infantile è fissata a 0,3 g/giorno di EPA + DHA, con almeno 0,2 g/giorno di DHA.
FAO Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010.
Sebbene i molteplici ruoli degli acidi grassi polinsaturi (PUFA) nella crescita e nella salute generale siano ben documentati, i dati sull’assunzione disponibili per la popolazione spagnola sono limitati e mancano di considerazioni sul genere e sull’età. Uno dei principali studi per valutare le fonti alimentari di omega-3 e l’adeguatezza dell’assunzione è stato condotto da Ortega et al. su un campione rappresentativo di adulti spagnoli (n = 1068 adulti, 521 uomini e 547 donne, di età compresa tra 17 e 60 anni, provenienti da dieci province spagnole).
Ortega, R.M.; González, L.G.; Villalobos, T.K.; Perea, J.M.; Aparicio, A.; López, A.M. Food sources and adequacy of intake of omega 3 and omega-6 fatty acids in a representative sample of Spanish adults. Nutr. Hosp. 2013, 28, 2236–2245.
L’assunzione è stata valutata nell’anno 2008 con un record alimentare su 3 giorni consecutivi, inclusa una domenica. I risultati hanno mostrato un contributo inadeguato di PUFA, dal momento che il 79,2% dei soggetti aveva un’assunzione <6% di TE. In particolare, il contributo di omega-3 PUFA (1,85 ± 0,82 g/giorno) ha fornito meno dell’1% di TE nell’85,3% dei soggetti e la combinazione di EPA + DHA (0,55 ± 0,58 g/giorno) non ha superato 0,5 g/giorno nel 64,6% del campione.
È interessante notare che lo studio longitudinale ECLIPSES su 479 donne in gravidanza spagnole ha riferito che, quelle di età avanzata e livello di istruzione superiore, mostravano concentrazioni sieriche di EPA e DHA significativamente più elevate e valori più bassi dei rapporti omega-6/omega-3 e AA/EPA.
Aparicio, E.; Martín-Grau, C.; Bedmar, C.; Serrat, N.; Basora, J.; Arija, V. Maternal Factors Associated with Levels of Fatty Acids, Specifically n-3 PUFA during Pregnancy: ECLIPSES Study. Nutrients 2021, 13, 317.
Un altro lavoro dello studio ANIBES condotto su donne spagnole in età fertile [31] ha già dimostrato la necessità di ottimizzare l’assunzione dietetica di questi micronutrienti che condividono molte funzioni con quelle degli omega-3 PUFA.
Redruello-Requejo, M.; Carretero-Krug, A.; Rodríguez-Alonso, P.; Samaniego-Vaesken, M.L.; Partearroyo, T.; Varela-Moreiras, G. Dietary Intake Adequacy and Food Sources of Nutrients Involved in the Methionine-Methylation Cycle in Women of Childbearing Age from the ANIBES Spanish Population. Nutrients 2021, 13,
A causa della loro implicazione nel metabolismo delle unità carboniose, l’acido folio, la vitamina B₁₂ e la colina svolgono un ruolo chiave nella regolazione dell’omocisteina plasmatica, con livelli elevati associati a diversi esiti negativi per la salute cognitiva, cerebrovascolare e cardiovascolare.
Strain, J.J.; Dowey, L.; Ward, M.; Pentieva, K.; McNulty, H. B-vitamins, homocysteine metabolism and CVD. Proc. Nutr. Soc. 2004, 63, 597–603.
Come affermato in precedenza, anche lo stato nutrizionale dei PUFA omega-3 (e omega-6) può avere un’influenza diretta su tali risultati. Inoltre, prove crescenti suggeriscono che la colina sia un nutriente perinatale critico con funzioni che potrebbero potenzialmente sovrapporsi a quelle del DHA [33,34].
Caudill, M.A.; Obeid, R.; Derbyshire, E.J.; Bernhard, W.; Lapid, K.; Walker, S.J.; Zeisel, S.H. Building better babies: Should choline supplementation be recommended for pregnant and lactating mothers? Literature overview and expert panel consensus. Gynecol. Obstet 2020, 2, 149–161.
Cook, S. Choline: A Critical Prenatal Nutrient. Res. Guide 2017
Le prove scientifiche hanno chiarito che non solo la quantità ma anche la qualità dei grassi alimentari influenza in modo critico la salute. In termini generali, i modelli alimentari di tipo occidentale forniscono principalmente LA (omega-6), una percentuale inferiore di ALA (omega-3) e, a seconda dell’assunzione di pesce, una percentuale variabile ma relativamente bassa di omega-3 LCPUFA, vale a dire AA, EPA, DHA e DPA
Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010.
Tuttavia, vale la pena notare che esiste una tendenza alla diminuzione dell’assunzione di EPA e DHA nelle fasce di età più giovani, sia nella popolazione generale che nelle donne in età fertile, un’osservazione che è stata confermata anche in altri studi [29,45].
Ortega, R.M.; González, L.G.; Villalobos, T.K.; Perea, J.M.; Aparicio, A.; López, A.M. Food sources and adequacy of intake of omega 3 and omega-6 fatty acids in a representative sample of Spanish adults. Nutr. Hosp. 2013, 28, 2236–2245.
Meyer, B.J.; Mann, N.J.; Lewis, J.L.; Milligan, G.C.; Sinclair, A.J.; Howe, P.R. Dietary intakes and food sources of omega-6 and omega-3 polyunsaturated fatty acids. Lipids 2003, 38, 391–398.
Ciò è coerente con l’osservazione che anche il consumo delle loro principali fonti alimentari, pesce e molluschi, segue la stessa tendenza, con assunzioni giornaliere medie significativamente inferiori nei bambini e negli adolescenti, rispetto ai gruppi di età più avanzata.
Partearroyo, T.; Samaniego-Vaesken, M.L.; Ruiz, E.; Aranceta-Bartrina, J.; Gil, Á.; González-Gross, M.; Ortega, R.M.; Serra-Majem, L.; Varela-Moreiras, G. Current food consumption amongst the Spanish ANIBES study population. Nutrients 2019, 11, 2663.
Di conseguenza, questi alimenti hanno fornito circa il doppio dell’energia totale nei gruppi di adulti (3,7%) e anziani (4,7%) della popolazione dello studio ANIBES rispetto ai gruppi di bambini e adolescenti (2,2% e 2,1%, rispettivamente).
Ruiz, E.; Ávila, J.M.; Valero, T.; del Pozo, S.; Rodríguez, P.; Aranceta-Bartrina, J.; Gil, Á.; González-Gross, M.; Ortega, R.M.; Serra-Majem, L. Energy Intake, Profile, and Dietary Sources in the Spanish Population: Findings of the ANIBES Study. Nutrients 2015, 7, 4739–4762.
I risultati degli studi che riportano la ridotta assunzione di PUFA omega-3 nelle donne, in particolare nelle età più giovani, sottolineano l’importanza di garantire un approvvigionamento adeguato nelle donne in gravidanza e in allattamento, date le potenziali implicazioni della dipendenza fetale dal DHA materno.
Una revisione sistematica mondiale dei dati provenienti da 40 paesi conferma che i gruppi di popolazione che destano maggiore preoccupazione per l’insufficienza di EPA e DHA sono quelli delle donne incinte e che allattano, insieme a neonati, bambini, adolescenti [50].
Harika, R.K.; Eilander, A.; Alssema, M.; Osendarp, S.J.; Zock, P.L. Intake of fatty acids in general populations worldwide does not meet dietary recommendations to prevent coronary heart disease: A systematic review of data from 40 countries. Ann. Nutr. Metab. 2013, 63, 229–238.
Il consumo medio di omega-6 e LA è più alto tra i gruppi più giovani, il che può anche essere spiegato dal maggiore consumo di carne e che probabilmente viene sostituito dal pesce consumo in età avanzata.
Nella popolazione anziana, il grado di inadeguatezza osservato per l’assunzione di LA è doppio rispetto alla media della popolazione. Uno studio sulla popolazione degli Stati Uniti dal 2012 al 2015 [6,47] non ha riportato tali differenze nell’assunzione di LA per età, dove i bambini hanno mostrato un’assunzione media di 13 g/giorno, ma gli anziani hanno raggiunto 15 g/giorno. Questi risultati suggeriscono che dovrebbe essere prestata particolare attenzione all’assunzione di questo nutriente nella anziana poiché LA non può essere sintetizzata dall’organismo ed è quindi un acido grasso essenziale necessario per mantenere l’integrità metabolica e la funzione cognitiva.
Le diete di tipo occidentale tendono a includere una quantità insufficiente di omega-3, mentre l’assunzione di omega-6 tende ad essere superiore a quella raccomandata. I rapporti sulla valutazione nutrizionale della dieta spagnola secondo il gruppo di consumo alimentare, il rapporto omega-6/omega -3 tra il 2000 e il 2006 è stato di circa 16:1, scendendo a 13:1 nel 2008.
Del Pozo, S.; García, V.; Cuadrado, C.; Ruiz, E.; Valero, T.; Ávila, J.M.; Varela, G. Valoración Nutricional de la Dieta Española de Acuerdo al Panel de Consumo Alimentario; Fundación Española de la Nutrición (FEN): Madrid, Spain, 2012; pp. 1–142.
Lo studio di Ortega et al. del 2008, riporta un rapporto di 7:1.
Ortega, R.M.; González, L.G.; Villalobos, T.K.; Perea, J.M.; Aparicio, A.; López, A.M. Food sources and adequacy of intake of omega 3 and omega-6 fatty acids in a representative sample of Spanish adults. Nutr. Hosp. 2013, 28, 2236–2245.
In un altro studio del. 2023 sulla popolazione spagnola il rapporto sale a favore degli omega-6 a 12:1, migliorando fino a 9:1 negli anziani.
Redruello-Requejo M, Samaniego-Vaesken ML, Puga AM, Montero-Bravo A, Ruperto M, Rodríguez-Alonso P, Partearroyo T, Varela-Moreiras G. Omega-3 and Omega-6 Polyunsaturated Fatty Acid Intakes, Determinants and Dietary Sources in the Spanish Population: Findings from the ANIBES Study. Nutrients. 2023 Jan 21;15(3):562.
Uno studio sulla popolazione statunitense con dati di assunzione dal 2012 al 2015 [6,47] ha riportato rapporti leggermente migliori di 9:1 per i bambini e 8:1 per gli anziani, dimostrando che una dieta di tipo occidentale non causerebbe necessariamente questo rapporto sfavorevole.
Sheppard, K.W.; Cheatham, C.L. Omega-6/omega-3 fatty acid intake of children and older adults in the US: Dietary intake in comparison to current dietary recommendations and the Healthy Eating Index. Lipids Health Dis. 2018, 17, 1–12.
Vyncke, K.E.; Libuda, L.; De Vriendt, T.; Moreno, L.A.; Van Winckel, M.; Manios, Y.; Gottrand, F.; Molnar, D.; Vanaelst, B.; Sjöström, M. Dietary fatty acid intake, its food sources and determinants in European adolescents: The HELENA (Healthy Lifestyle in Europe by Nutrition in Adolescence) Study. Br. J. Nutr. 2012, 108, 2261–2273.
Lo studio HELENA sugli adolescenti europei [47] ha descritto un rapporto di 6:1 che non differiva significativamente tra ragazzi e ragazze. Va notato che altri fattori di confusione possono influenzare le assunzioni osservate, poiché nel presente studio gli individui che presentano obesità hanno mostrato un’assunzione significativamente inferiore di omega-6 e quindi un rapporto significativamente inferiore rispetto agli individui sottopeso, ma non rispetto a quelli con peso normale o sovrappeso, in base al BMI.
Vyncke, K.E.; Libuda, L.; De Vriendt, T.; Moreno, L.A.; Van Winckel, M.; Manios, Y.; Gottrand, F.; Molnar, D.; Vanaelst, B.; Sjöström, M. Dietary fatty acid intake, its food sources and determinants in European adolescents: The HELENA (Healthy Lifestyle in Europe by Nutrition in Adolescence) Study. Br. J. Nutr. 2012, 108, 2261–2273.
Né la Società Spagnola di Nutrizione Comunitaria (SENC) né l’EFSA o il gruppo di esperti FAO/OMS hanno stabilito alcuna raccomandazione riguardante il rapporto omega-6/omega-3, ritenendolo ridondante se l’assunzione di entrambe le serie di PUFA rientrano nelle raccomandazioni. Tuttavia, le prove disponibili supportano rapporti inferiori a 10 per essere più ottimali, poiché rapporti più elevati potrebbero portare a maggiori concentrazioni di AA nelle membrane cellulari, ostacolando così la sintesi di mediatori anti-infiammatori da EPA e DHA.
heppard, K.W.; Cheatham, C.L. Omega-6/omega-3 fatty acid intake of children and older adults in the US: Dietary intake in comparison to current dietary recommendations and the Healthy Eating Index. Lipids Health Dis. 2018, 17, 1–12
Sebbene diversi studi abbiano associato alti rapporti omega-6/omega-3 con un maggior rischio di cancro [52,53], questa associazione non è stata osservata per elevate assunzioni di soli omega-6, pertanto le attuali raccomandazioni si concentrano sull’assunzione assoluta di EPA e DHA [13].
Geelen, A.; Schouten, J.M.; Kamphuis, C.; Stam, B.E.; Burema, J.; Renkema, J.M.; Bakker, E.J.; van’t Veer, P.; Kampman, E. Fish consumption, n-3 fatty acids, and colorectal cancer: A meta-analysis of prospective cohort studies. Am. J. Epidemiol. 2007, 166, 1116–1125
Gerber, M. Background review paper on total fat, fatty acid intake and cancers. Ann. Nutr. Metab. 2009, 55, 140–161.
FAO Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010.
I risultati suggeriscono che la strategia per migliorare il rapporto dietetico dovrebbe concentrarsi sul miglioramento dell’assunzione di PUFA omega-3, per i quali sono stati riscontrati alti livelli di inadeguatezza nell’intera popolazione. Nel frattempo, l’adeguatezza osservata per l’assunzione di omega-6 è relativamente accettabile e non giustificherebbe un intervento in tal senso. Infatti, diversi studi suggeriscono che assunzioni moderate di omega-6 PUFA LA (5-8% TE) non portano a maggiori aumenti di AA e quindi non aumentano la formazione di mediatori pro-infiammatori associati all’assunzione di omega-6 PUFA [13,54].
FAO Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010.
Wijendran, V.; Hayes, K. Dietary n-6 and n-3 fatty acid balance and cardiovascular health. Annu. Rev. Nutr.2004, 24, 597–615.
Un altro indice di qualità della dieta è il rapporto EPA/DHA. Anche questo parametro è rilevante in quanto alcuni studi hanno evidenziato che esiste una grande variabilità nel rapporto EPA/DHA nelle diete e negli integratori e che la sua modifica può avere un’influenza specifica su diverse patologie cardiovascolari o neurologiche [55,56].
Cottin, S.; Sanders, T.; Hall, W. The differential effects of EPA and DHA on cardiovascular risk factors. Proc. Nutr. Soc. 2011, 70, 215–231
Ortega, R.; Rodríguez-Rodríguez, E.; López-Sobaler, A. Effects of omega 3 fatty acids supplementation in behavior and non-neurodegenerative neuropsychiatric disorders. Br. J. Nutr. 2012, 107, S261–S270.
Tuttavia, per il momento non sono state emesse raccomandazioni specifiche. Considerando la raccomandazione FAO/OMS per le donne adulte in gravidanza e in allattamento, 0,3 g/giorno di EPA + DHA con almeno 0,2 g/giorno di DHA], si potrebbe derivare un rapporto EPA/DHA raccomandato di 1,5.
FAO Joint. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation, 10–14 November 2008, Geneva; FAO: Rome, Italy, 2010.
Sorprendentemente, sia il pesce che i crostacei e la carne e i prodotti a base di carne hanno contribuito in misura simile all’assunzione totale di omega-3 tra la popolazione spagnola ANIBES. Sebbene seguita da vicino dalla carne e dai prodotti a base di carne, nel lavoro di Ortega et al., pesce e crostacei sono rimasti la principale fonte di PUFA omega-3 nella popolazione spagnola, un modello che ora è stato osservato solo per la popolazione anziana dello studio ANIBES. Al contrario, per gli adulti, il contributo di entrambi i gruppi alimentari all’assunzione totale di omega-3 era praticamente lo stesso. Inoltre, nei bambini e negli adolescenti, la carne e i prodotti a base di carne hanno sostituito il pesce e i molluschi come fonte principale della loro assunzione di PUFA omega-3, contribuendo in modo significativamente maggiore rispetto ai gruppi di età più avanzata, mentre il pesce e i molluschi hanno contribuito in misura significativamente inferiore. Come è o, forse, era caratteristico delle popolazioni mediterranee, la popolazione spagnola ha solitamente mostrato un elevato consumo di pesce, superiore a quello di altri paesi occidentali [57] e solo inferiore a quello del Giappone [58].
Sioen, I.; van Lieshout, L.; Eilander, A.; Fleith, M.; Lohner, S.; Szommer, A.; Petisca, C.; Eussen, S.; Forsyth, S.; Calder, P.C. Systematic review on n-3 and n-6 polyunsaturated fatty acid intake in European countries in light of the current recommendations-Focus on specific population groups. Ann. Nutr. Metab. 2017, 70, 39–50.
Umesawa, M.; Yamagishi, K.; Iso, H. Intake of fish and long-chain n-3 polyunsaturated fatty acids and risk of diseases in a Japanese population: A narrative review. Eur. J. Clin. Nutr.2021, 75, 902–920.
Tuttavia, il consumo di pesce e molluschi è diminuito di quasi il 30% negli ultimi anni in Spagna, soprattutto per i gruppi di popolazione più giovani. Questo calo del consumo di pesce e molluschi potrebbe spiegare il peggioramento della situazione relativa all’assunzione insufficiente di omega-3 rispetto ai risultati precedenti.
Ortega, R.M.; González, L.G.; Villalobos, T.K.; Perea, J.M.; Aparicio, A.; López, A.M. Food sources and adequacy of intake of omega 3 and omega-6 fatty acids in a representative sample of Spanish adults. Nutr. Hosp. 2013, 28, 2236–2245.
Infatti, all’interno della popolazione ANIBES, il consumo medio giornaliero di carne e prodotti a base di idromele era più del doppio di quello di pesce e molluschi, con bambini e adolescenti che mostravano un consumo significativamente più elevato di carne e prodotti a base di carne, e significativamente inferiore per pesce e molluschi, rispetto agli anziani gruppi.
Partearroyo, T.; Samaniego-Vaesken, M.L.; Ruiz, E.; Aranceta-Bartrina, J.; Gil, Á.; González-Gross, M.; Ortega, R.M.; Serra-Majem, L.; Varela-Moreiras, G. Current food consumption amongst the Spanish ANIBES study population. Nutrients 2019, 11, 2663.
Allo stesso modo, nello studio HELENA, la carne e i prodotti a base di carne hanno contribuito quasi il doppio rispetto a pesce e crostacei all’assunzione totale di omega-3 degli adolescenti europei. Tuttavia, è imperativo evidenziare che nel nostro studio carne e prodotti a base di carne fornivano solo PUFA omega-3 sotto forma di ALA, che non garantirebbero un adeguato stato nutrizionale di EPA e/o DHA a causa della conversione metabolica molto limitata da ALA dietetico [8].
Vyncke, K.E.; Libuda, L.; De Vriendt, T.; Moreno, L.A.; Van Winckel, M.; Manios, Y.; Gottrand, F.; Molnar, D.; Vanaelst, B.; Sjöström, M. Dietary fatty acid intake, its food sources and determinants in European adolescents: The HELENA (Healthy Lifestyle in Europe by Nutrition in Adolescence) Study. Br. J. Nutr. 2012, 108, 2261–2273.
urdge, G.C.; Calder, P.C. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod. Nutr. Dev. 2005, 45, 581–597.
Questo è esattamente il motivo per cui l’analisi delle assunzioni e delle fonti alimentari dei singoli PUFA, piuttosto che della serie di omega-3 nel suo insieme, è di particolare rilevanza.
Per quanto riguarda l’assunzione dietetica di EPA e DHA, pesce e crostacei sono stati i principali e quasi esclusivi contributori alle assunzioni osservate in tutte le fasce di età. Allo stesso modo, nella popolazione europea dello studio HELENA [47] pesce e crostacei erano la principale fonte di EPA e DHA; e anche altri studi sulla popolazione adulta europea hanno trovato risultati simili [43,44].
Vyncke, K.E.; Libuda, L.; De Vriendt, T.; Moreno, L.A.; Van Winckel, M.; Manios, Y.; Gottrand, F.; Molnar, D.; Vanaelst, B.; Sjöström, M. Dietary fatty acid intake, its food sources and determinants in European adolescents: The HELENA (Healthy Lifestyle in Europe by Nutrition in Adolescence) Study. Br. J. Nutr. 2012, 108, 2261–2273.
Astorg, P.; Arnault, N.; Czernichow, S.; Noisette, N.; Galan, P.; Hercberg, S. Dietary intakes and food sources of n-6 and n-3 PUFA in french adult men and women. Lipids 2004, 39, 527–535.
Sioen, I.A.; Pynaert, I.; Matthys, C.; De Backer, G.; Van Camp, J.; De Henauw, S. Dietary intakes and food sources of fatty acids for Belgian women, focused on n-6 and n-3 polyunsaturated fatty acids. Lipids 2006, 41, 415–422.
Le strategie per aumentare l’assunzione di EPA e DHA devono necessariamente prevedere un aumento del consumo di pesce e molluschi o, in alternativa, integratori come necessario sostituto. Analizzando le fonti alimentari osservate di ALA, è forse questo acido grasso per il quale abbiamo riscontrato le maggiori differenze con altre popolazioni. Si osserva che carne e prodotti a base di carne insieme a oli e grassi sono i maggiori contributori per la popolazione spagnola, qualcosa che varia da altre popolazioni europee, dove carne e prodotti a base di carne non erano così rilevanti. Negli adulti francesi, i latticini erano la principale fonte di cibo e il contributo di oli e grassi era minore, mentre nelle donne belghe, grassi e oli fornivano quasi la metà dell’ALA consumato [43,44].
Astorg, P.; Arnault, N.; Czernichow, S.; Noisette, N.; Galan, P.; Hercberg, S. Dietary intakes and food sources of n-6 and n-3 PUFA in french adult men and women. Lipids 2004, 39, 527–535.
Sioen, I.A.; Pynaert, I.; Matthys, C.; De Backer, G.; Van Camp, J.; De Henauw, S. Dietary intakes and food sources of fatty acids for Belgian women, focused on n-6 and n-3 polyunsaturated fatty acids. Lipids 2006, 41, 415–422.
Per quanto riguarda i PUFA omega-6, le principali fonti alimentari e i loro apporti sono molto simili a quelli descritti da Ortega et al. nella popolazione spagnola, e anche agli studi europei disponibili.
storg, P.; Arnault, N.; Czernichow, S.; Noisette, N.; Galan, P.; Hercberg, S. Dietary intakes and food sources of n-6 and n-3 PUFA in french adult men and women. Lipids 2004, 39, 527–535.
Sioen, I.A.; Pynaert, I.; Matthys, C.; De Backer, G.; Van Camp, J.; De Henauw, S. Dietary intakes and food sources of fatty acids for Belgian women, focused on n-6 and n-3 polyunsaturated fatty acids. Lipids 2006, 41, 415–422.
Vale la pena ricordare che negli adolescenti nello studio HELENA il contributo di oli e grassi all’assunzione totale di omega-6 e LA era molto inferiore.
Vyncke, K.E.; Libuda, L.; De Vriendt, T.; Moreno, L.A.; Van Winckel, M.; Manios, Y.; Gottrand, F.; Molnar, D.; Vanaelst, B.; Sjöström, M. Dietary fatty acid intake, its food sources and determinants in European adolescents: The HELENA (Healthy Lifestyle in Europe by Nutrition in Adolescence) Study. Br. J. Nutr. 2012, 108, 2261–2273.
Al contrario, il consumo di oli e grassi osservato nella popolazione spagnola potrebbe rappresentare una strategia interessante per aumentare lo stato di EPA e DHA, poiché alcuni rapporti hanno suggerito che la sintesi di EPA e DHA potrebbe essere migliorata dall’assunzione a lungo termine di oli vegetali contenenti più ALA e meno LA (olio di colza, soia o noce).
Goyens, P.L.; Spilker, M.E.; Zock, P.L.; Katan, M.B.; Mensink, R.P. Conversion of α-linolenic acid in humans is influenced by the absolute amounts of α-linolenic acid and linoleic acid in the diet and not by their ratio. Am. J. Clin. Nutr. 2006, 84, 44–53.
Vani, A.; Laxmi, R.; Sesikeran, B. Effects of dietary α-linolenic acid from blended oils on biochemical indices of coronary heart disease in Indians. Lipids 2002, 37, 1077–1086.
Questa osservazione potrebbe essere di grande interesse per i gruppi di popolazione che consumano meno pesce, come i giovani e i gruppi vegetariani o vegani, dato che nella popolazione spagnola il contributo di oli e grassi all’assunzione di ALA è già importante. Tuttavia, la conversione di ALA in EPA e DHA è limitata e varia notevolmente tra le popolazioni.
Burdge, G.C.; Calder, P.C. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod. Nutr. Dev. 2005, 45, 581–597.
Inoltre, questa strategia non sarebbe ottimale per la popolazione senior spagnola, per la quale sono state osservate assunzioni significativamente inferiori di LA. D’altra parte, anche l’assunzione di lipidi deve essere bilanciata a livello globale, e non solo per quanto riguarda la serie omega-3 e 6 dei PUFA. Pertanto, dovrebbe essere prestata attenzione generale ai modelli dietetici quando si suggeriscono strategie come la modifica dell’assunzione di oli vegetali, considerando che un aspetto positivo dei modelli osservati tra la popolazione spagnola dallo studio ANIBES è il contributo relativamente elevato di acidi grassi monoinsaturi (MUFA), dovuto in gran parte all’uso comune dell’olio di oliva.
Ruiz, E.; Ávila, J.M.; Valero, T.; del Pozo, S.; Rodríguez, P.; Aranceta-Bartrina, J.; Gil, Á.; González-Gross, M.; Ortega, R.M.; Serra-Majem, L. Energy Intake, Profile, and Dietary Sources in the Spanish Population: Findings of the ANIBES Study. Nutrients 2015, 7, 4739–4762.
Occorre aumentare la consapevolezza sull’ottimizzazione dello stato di questi nutrienti, dove più della metà della popolazione non consumerebbe abbastanza PUFA e FA omega-3; e un quarto né PUFA omega-3 e vitamina B₁₂ né PUFA omega-3 e colina. Questi nutrienti potrebbero congiuntamente influire, seppure con meccanismi diversi, su prevenzione di eventi cerebrovascolari, sviluppo e mantenimento della funzione cognitiva. Perciò, le possibili conseguenze di un inadeguato apporto combinato di omega-3 PUFA con AF , vitamina B₁₂ e colina non possono essere ignorate quando si mira a migliorare lo stato nutrizionale della popolazione. Probabilmente alcuni degli effetti positivi associati a una sufficiente assunzione di acidi grassi omega-3 (effetti anti-iperlipidemia, anti-infiammatori, anti-ipertensivi, anti infiammatori o anti-trombotici [61]) non possono essere pienamente esercitati senza garantire il corretto stato nutrizionale di altri micronutrienti sinergici.
Ubeda, N.; Achón, M.; Varela-Moreiras, G. Omega 3 fatty acids in the elderly. Br. J. Nutr. 2012, 107, S137–S151.
Pertanto, tutti questi dati supportano la necessità di considerare l’utilità di integratori multivitaminici combinati, per contribuire a garantire l’adeguato apporto di tutti questi nutrienti lungo le diverse fasi della vita, compresa la gravidanza e l’allattamento.
Alla luce dell’elevata percentuale di individui che non soddisfano gli obiettivi nutrizionali fissati per omega-3 PUFA, ALA, EPA e DHA, è consigliabile aumentare il consumo di pesce e/o alimenti arricchiti e/o integratori alimentari con questi acidi grassi. Ciò sarebbe di particolare rilevanza durante la gravidanza e l’allattamento, ma anche nell’età anziana, dati i ruoli di EPA e DHA nello sviluppo e nella funzione neurologica e visiva. Questi sforzi dovrebbero anche rappresentare la strategia principale per l’ottimizzazione del rapporto omega-6/omega-3, poiché l’adeguatezza osservata per l’assunzione di PUFA omega-6 tra è relativamente accettabile.
I risultati evidenziano l’urgente necessità di stabilire le priorità e discutere le politiche di integrazione nutrizionale per tutti questi componenti, seguendo l’approccio adottato con l’acido folico e considerando sia i benefici che i rischi. Ciò faciliterebbe il rispetto dei requisiti individuali in modo tempestivo ed efficace, sottolineando l’importanza di migliorare l’assunzione dietetica di nutrienti chiave.
Da alcuni studi si deduce che l’uomo cacciatore-raccoglitore consumava quantità quasi uguali di acidi grassi omega-3; l’indice di omega-3 era vicino a 1:1. La dieta dell’uomo moderno, invece, contiene pochissimi omega-3, essendo francamente sbilanciata verso gli omega-6.
INDICE OMEGA-3 IDEALE: 1:5
INDICE OMEGA-3 REALE ODIERNO: 1:10, 1:20 o anche 1:50.
Si ritiene che questo rapporto 1:5 sia ideale perché gli acidi grassi omega-3 (ALA) e omega-6 (LA) vengono trasformati dallo stesso insieme di elongasi e desaturasi in acidi grassi altamente insaturi (HUFA), EPA e DHA (entrambi omega-3) e AA (omega-6). Livelli cinque volte superiori di omega-6 non influenzano la conversione di omega-3 PUFA in omega-3 HUFA.
Questo perché le elongasi e le desaturasi hanno una maggiore affinità con gli acidi grassi omega-3 rispetto agli acidi grassi omega-6. Pertanto, anche a livelli cinque volte inferiori di grassi omega-3 PUFA possono essere convertiti ugualmente. Gli acidi grassi Omega-3 sono uno dei nutrienti essenziali più ricercati.
Al fine di ridurre il consumo di acidi grassi omega-6, l’acido oleico omega-9 (olio d’oliva MUFA) viene promosso in tutto il mondo .
Schwingshackl L, Hoffmann G. Monounsaturated fatty acids, olive oil and health status: a systematic review and meta-analysis of cohort studies. Lipids Health Dis. 2014;13:154.
I radicali liberi sono molecole (come le specie reattive dell’ossigeno: ROS) che, avendo perso un elettrone, sono diventate molto instabili. Perciò, sono altamente reattive e possono sottrarre elettroni alle molecole vicine. Agiscono come terroristi nel corpo, attaccando le proteine vitali (come il DNA), portando a disfunzioni, mutazioni e cancro. Attaccando proteine ed enzimi, li inattivano e quindi interrompono le normali attività che queste molecole svolgono. I radicali liberi attaccano le membrane cellulari. Nel caso delle cellule che rivestono i nostri vasi sanguigni (cellule endoteliali), ne promuovono l’indurimento e l’ispessimento delle pareti, favorendo infarti e ictus. L’attacco dei radicali liberi al collagene può causare reticolazione, con conseguente rigidità delle articolazioni. Pertanto, l ROS contribuiscono sia all’inizio che alla promozione di molte delle principali malattie.
Lobo V, Patil A, Phatak A, Chandra N. Free radicals, antioxidants and functional foods: Impact on human health. Pharmacogn Rev. 2010;4:118–26.
Questo attacco costante di ROS è anche indicato come stress ossidativo.
Petersen OH, Spät A, Verkhratsky A. Introduction: reactive oxygen species in health and disease. Phil Soc R Soc B. 2005;360:2197–9.
Sotto stress ossidativo, l’anello più debole del corpo può essere il primo a cedere il passo a una specifica malattia, in parte determinata dalla predisposizione genetica.
Amira AM. Oxidative stress and disease an updated review. Res J Immunol. 2010;3:129–45.
Lo stress ossidativo è una condizione in cui i ROS superano la capacità tampone antiossidante disponibile.
Tiwari AK. Imbalance in antioxidant defense and human diseases. Curr Sci. 2001;81:1179–87.
Sarebbe sbagliato dedurre che i radicali liberi sono sempre cattivi. I radicali liberi e gli antiossidanti svolgono un duplice ruolo sia composti tossici che benefici, poiché possono essere dannosi o utili per il corpo.
Tiwari AK. Imbalance in antioxidant defense and human diseases. Curr Sci. 2001;81:1179–87.
Il corpo umano ha trilioni di cellule di oltre 200 tipi diversi che compongono i vari organi, cuore, cervello, reni, fegato e polmoni. In ogni cellula ci sono numerosi organelli più piccoli, i mitocondri, la centrale elettrica della cellula. Ogni cellula genera ROS se non può neutralizzarlo efficacemente con la sua capacità tampone antiossidante disponibile; lo stress ossidativo sarà indotto potenzialmente danneggiando la cellula e inevitabilmente può avviare il processo patologico. Per impedire la formazione eccessiva di radicale liberi, il corpo possiede un complesso sistema antiossidante.
Pham-Huy LA, He H, Pham-Huy C. Free radicals, antioxidants, in disease and health. Int J Biomed Sci. 2008;4:82–96.
La nostra salute è in gran parte governata dall’alimentazione. Oggi ci troviamo di fronte a una situazione molto particolare di malnutrizione e ipernutrizione (paesi più sviluppati) o denutrizione (paesi meno sviluppati). Sta diventando sempre più evidente dalle recenti ricerche che il nostro problema di salute ha origine principalmente dall’inadeguato apporto di nutrienti essenziali. Abbiamo bisogno di oltre 40 nutrienti essenziali: vitamine, aminoacidi essenziali, minerali e acidi grassi omega-3. Di questi nutrienti essenziali, la carenza di acidi grassi omega nella dieta umana moderna è responsabile in modo molto importante del nostro stato di salute.
Gli Omega-3 sono molto importanti per vari motivi. Fanno parte della membrana cellulare; influiscono in modo importante sulla coagulazione del sangue, sulla la contrazione e il rilassamento delle pareti delle arterie e l’infiammazione. Sia gli omega-6 che gli omega-3 sono essenziali. Tuttavia, la maggior parte di noi assume troppi omega-6 e pochissimi acidi grassi omega-3, vivendo una situazione di sovralimentazione di omega-6 e sottonutrizione di acidi grassi omega-3. Questo squilibrio è in gran parte la causa principale dell’aumento della gravità e dell’incidenza di diverse malattie, tra cui malattie cardiache, diabete, artrite, cancro, disturbi mentali, complicanze della gravidanza. Il ruolo degli omega-3 è ben noto durante la gravidanza, in particolare per la funzione dei nervi e degli occhi del bambino. Pertanto, è fondamentale fornire un adeguato apporto di acidi grassi polinsaturi omega-3 durante l’ultimo trimestre.
Tur JA, Bibiloni MM, Sureda A, Pons A. Dietary sources of omega 3 fatty acids: public health risks and benefits. Br J Nutr. 2012;107 (2):S23–52.
Il rapporto tra omega-6 e 3 (2,3:1) è raccomandato in modo da massimizzare la conversione da ALA a DHA.
ALA: acido α-linolenico. Un acido grasso insaturo della serie omega-3 (18:3 ω3).
DHA: acido docosaesaenoico, è un acido grasso omega-3. Il DHA è un componente strutturale primario del cervello umano, della corteccia cerebrale, della pelle e della retina.
EPA: acido eicosapentaenoico, detto anche acido icosapentaenoico, è un acido grasso omega-3. Il suo nome in letteratura è 20:5.
In quanto essenziale deve essere necessariamente introdotto con l’alimentazione perché l’organismo umano non è in grado di sintetizzarlo autonomamente. Poiché omega-3 e omega-6 si contendono (competono) gli stessi enzimi (desaturasi ed elongasi) per dare origine alle molecole più attive, un apporto più alto di omega-6 (acido linoleico) nella dieta può influenzare la conversione di ALA in EPA e DHA.
Il 15% dell’ALA alimentare viene convertito negli acidi grassi omega-3 a catena lunga, di cui l’acido eicosapentaenoico (EPA; 20:5) e l’acido docosaesaenoico (DHA; 22:6 ) predominano all’assunzione tipica sia di acido linoleico (LA; 18:2), 15 g/die (5% di energia) che di acido alfa-linolenico (ALA; 18:3) 2 g/die (0,6% di energia).
Simopoulos AP. The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomed Pharmacother. 2002;56(8):365–79.
Quantitativamente, questa conversione comporta la produzione da ALA di 300 mg di acidi grassi a catena lunga n-3. Quando l’acido linoleico nella dieta viene aumentato a 30 g/die, la conversione di ALA in acidi grassi omega-3 a catena lunga si riduce del 40%.
Goyens PL, Spilker ME, Zock PL, Katan MB, Mensink RP. Conversion of a-linolenic acid in humans is influenced by the absolute amounts of a-linolenic acid and linoleic acid in the diet and not by their ratio. Am J Clin Nutr. 2006;84(1):44–53.
Pertanto, le condizioni che favoriscono la massima conversione di ALA in EPA e DHA dipendono in modo critico dalla quantità di acido linoleico nella dieta.
Hussein H, Ah-Sing E, Wilkinson P, Leach C, Griffin BA, Millward DJ. Long-chain conversion of [13C] linoleic acid and-linolenic acid in response to marked changes in their dietary intake in men. J Lipid Res. 2005;46:269–80.
Quantitativamente, questa conversione comporta la derivazione da ALA di 300 mg di acidi grassi a catena lunga n-3. Quando l’acido linoleico nella dieta viene aumentato a 30 g/die, la conversione di ALA in acidi grassi omega-3 a catena lunga si riduce del 40% [5].
Goyens PL, Spilker ME, Zock PL, Katan MB, Mensink RP. Conversion of a-linolenic acid in humans is influenced by the absolute amounts of a-linolenic acid and linoleic acid in the diet and not by their ratio. Am J Clin Nutr. 2006;84(1):44–53.
Pertanto, le condizioni che favoriscono la massima conversione di ALA in EPA e DHA dipendono in modo critico dalla quantità di acido linoleico nella dieta [6].
Hussein H, Ah-Sing E, Wilkinson P, Leach C, Griffin BA, Millward DJ. Long-chain conversion of [13C] linoleic acid and-linolenic acid in response to marked changes in their dietary intake in men. J Lipid Res. 2005;46:269–80.
Uno studio sul metabolismo degli Inuit (Popolazione indigena delle coste artiche dell’America, distribuita dalla Groenlandia sino all’Alaska; in Asia occupano l’estremità della penisola dei Ciukci) ha rivelato che gli acidi grassi omega-3 derivati dal pesce sono protettivi. Sembrava che gli Inuit fossero protetti dalle malattie cardiovascolari e la bassa incidenza era attribuita alla loro dieta ricca di grassi, nella tradizionale dieta dei mammiferi marini. In base a questi risultati, milioni di occidentali consumano olio di pesce per prevenire le malattie cardiache. La rarità della cardiopatia ischemica negli Inuit della Groenlandia, un tempo noti come eschimesi, può essere in parte spiegata dall’effetto antitrombotico delle diete a catena lunga ricche di oli marini.
Bang HO, Dyerberg J, Sinclair HM. The composition of the Eskimo food in north western Greenland. Am J Clin Nutr. 1980;33 (12):2657–61.
Associando la bassa incidenza di malattie cardiovascolari osservata nelle popolazioni Inuit alla loro dieta tradizionale, ricca di grassi di mammiferi marini, l’olio di pesce è stato considerato protettivo. Queste conclusioni, alla fine, portarono alla raccomandazione che gli occidentali mangiassero più pesce per aiutare a prevenire le malattie cardiache. Decine di persone richiesero le pillole di olio di pesce. Recentemente, sono state dimostrate negli Inuit della Groenlandia caratteristiche genetiche di adattamento climatico e dietetico,
Fumagalli M, Moltke I, Grarup N, Racimo F, Bjerregaard P, Jørgensen ME, Korneliussen TS, Gerbault P, Skotte L, Lin- neberg A, Christensen C, Brandslund I, Jørgensen T, Huerta-Sánchez E, Schmidt EB, Pedersen O, Hansen T, Albrechtsen A, Nielsen R. Greenlandic inuit show genetic signatures of diet and climate adaptation. Science. 2015;349(6254):1343–7.
Gli effetti negativi sulla salute di una dieta ricca di grassi sono controbilanciati da una dieta ricca di omega-3 (EPA e DHA). Gli Inuit presentano mutazioni genetiche uniche, quasi nel 100% della popolazione, rispetto al solo 2% negli europei e il 15% nei cinesi Han. La caratteristica genetica più importante dell’adattamento è stata trovata sul cromosoma 11 nel gruppo delle desaturasi degli acidi grassi.
Due geni FADS1 e FADS2, che codificano per la desaturasi delta 5 e delta 6 (D5D, D6D), sono fattori limitanti della velocità e sono stati selezionati per l’adattamento alla dieta Inuit. Questa mutazione è vitale per la sopravvivenza degli Inuit con una dieta ricca di grassi. È stato anche notato che la mutazione è risultata essere fortemente associata all’altezza perché la crescita è in parte regolata dal profilo degli acidi grassi della persona, che influenza anche la regolazione degli ormoni della crescita. Quindi sembra che ciò che è vero per la dieta a base di pesci degli Inuit, ad alto contenuto di EPA e DHA, potrebbe non essere immediatamente vero per tutti gli altri.

Differenza nel tipo di acidi grassi omega-3 e omega-6 tra vegetariani e non vegetariani.
Gli oli di pesce forniscono una fonte di EPA e DHA, due acidi grassi ora riconosciuti importanti per la salute umana.
Calder PC. n-3 polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am J Clin Nutr. 2006;83(6):1505S–1519S
La crescente domanda di oli di pesce contenenti EPA e DHA sta mettendo sotto pressione specie e numeri di pesci.
Lenihan-Geels G, Bishop KS, Ferguson LR. Alternative sources of omega-3 fats: can we find a sustainable substitute for fish? Nutrients. 2013;5(4):1301–15.
La pesca fornisce pesce per il consumo umano a un tasso storico massimo, suggerendo che la pesca su larga scala non è più sostenibile. L’alto tasso di pesca si traduce in un effetto sostanziale sui livelli di pesce con la possibilità di estinzione.
Dulvy NK, Sadovy Y, Reynolds JD. Extinction vulnerability in marine populations. Fish Fish. 2003;4(1):25–64.
Gli stock ittici mondiali stanno rapidamente diminuendo ed è stato stimato che il 100 % dei taxa ittici mondiali sarà esaurito entro il 2048.
Dulvy NK, Sadovy Y, Reynolds JD. Extinction vulnerability in marine populations. Fish Fish. 2003;4(1):25–64.Worm B, Barbier EB, Beaumont N, Duffy JE, Folke C, Halpern BS, Jackson JBC, Lotze HK, Micheli F, Palumbi SR, Sala E, Selkoe KA, Stachowicz JJ, Watson R. Impacts of biodiversity loss on ocean ecosystem services. Science. 2006;314:787.
Le principali fonti di questi acidi grassi omega-3 sono le specie di pesci grassi tra cui salmone, sgombro e aringa.
Strobel C, Jahreis G, Kuhnt K. Survey of n-3 and n-6 polyunsat- urated fatty acids in fish and fish products. Lipids Health Dis. 2012;30(11):144.
Inoltre, i numerosi benefici per la salute derivanti dal consumo di pesce possono essere compromessi dalla presenza di metalli e metalloidi tossici come piombo, cadmio, arsenico e mercurio, che possono avere effetti dannosi sull’organismo umano se consumati in quantità tossiche.
Bosch AC, O’Neill B, Sigge GO, Kerwath SE, Hoffman LC. Heavy metals in marine fish meat and consumer health: a review. J Sci Food Agric. 2016;96(1):32–48.
Le proprietà benefichei degli acidi grassi omega-3 sono ormai ben consolidate. L’alta prevalenza di malattie degenerative è principalmente attribuita alla scarsità di acidi grassi omega-3 nella dieta umana. Al fine di proteggere le specie ittiche e gli ecosistemi oceanici, sono necessarie fonti sostenibili alternative di acidi grassi omega-3.
L’olio di pesce e l’olio DHA algale hanno problemi di compliance del paziente nella terapia ad alte dosi a causa del sapore di pesce e dei disturbi gastrointestinali. Sono stati esaminati i benefici e i rischi di alghe, olio di pesce, piante, latticini arricchiti con acidi grassi omega-3, alimenti di origine animale, olio di krill e olio di foca.
Tur JA, Bibiloni MM, Sureda A, Pons A. Dietary sources of omega 3 fatty acids: public health risks and benefits. Br J Nutr. 2012;107 (2):S23–52.
Le alghe rappresentano le fondamenta della catena alimentare oceanica. Nello specifico, le alghe sintetizzano gli acidi grassi omega-3 che vengono successivamente consumati da altre forme di vita marina. Il costo dei metodi di estrazione e purificazione stanno attualmente limitando il potenziale di utilizzo di oli micro-algali su larga scala.
Adarme-Vega TC, Lim DKY, Timmins M, Vernen F, Li Y, Schenk PM. Microalgal biofactories: a promising approach towards sustainable omega-3 fatty acid production. Microb Cell Fact. 2012;11:96.
Ovviamente, non tutti gli acidi grassi omega-3 sono uguali. L’ALA è disponibile da fonti vegetali e i semi di lino sono la fonte vegetariana più ricca di ALA. L’ALA non può essere sintetizzato nel corpo umano e quindi è un nutriente essenziale. L’ALA è un precursore di EPA e DHA, che sono acidi grassi omega-3 fisiologicamente più potenti. Il pesce è una buona fonte diretta di EPA e DHA e quindi è considerato più efficace. Si ritiene che l’ALA non sia convertito in modo efficiente in EPA e DHA, per cui EPA e DHA sono, a loro volta, considerati essenziali. L’ALA è l’unica forma di acido grasso omega-3 disponibile per i vegetariani e quindi c’è una controversia sul fatto che l’ALA possa davvero soddisfare adeguatamente i bisogni di omega-3 dei vegetariani. Poiché la conversione dell’ALA ingerito in DHA è soltanto parziale, il quantitativo di DHA che si trova nel compartimento sanguigno corrisponde a una porzione molto piccola del DHA sintetizzato dall’ALA. Queste stime sono probabilmente sottostime dell’effettiva sintesi di DHA dall’ALA negli esseri umani.
Couëdelo L, Boué-Vaysse C, Fonseca L, Montesinos E, Djouk- itch S, Combe N, Cansell M. Lymphatic absorption of a-linolenic acid in rats fed flaxseed oil-based emulsion. Br J Nutr. 2011;105 (7):1026–35.
Quando l’ALA viene somministrato per via orale, viene assorbito nel sistema linfatico e quindi entra nella circolazione sistemica. Questo è problematico per gli studi sui traccianti umani che somministrano ALA per via orale e misurano l’aspetto i prodotti derivati nel plasma, poiché una grande porzione del tracciante sarà assorbita dai tessuti e dal tessuto adiposo e non raggiungerà il fegato e, quindi, il plasma. Nel 2009, Barcelo-Coblijn e Murphy hanno elegantemente sostenuto che l’ALA alimentare contribuisce in modo significativo al DHA tissutale.
Barceló-Coblijn G, Murphy EJ. Alpha-linolenic acid and its conversion to longer chain n-3 fatty acids: benefits for human health and a role in maintaining tissue n-3 fatty acid levels. Prog Lipid Res. 2009;48(6):355–74.
La questione pertinente sollevata è se un animale terrestre (umano) onnivoro, richieda veramente DHA alimentare di origine marina, al fine di avere prestazioni fisiologiche ottimali, nonostante la vera rarità del DHA nella rete trofica terrestre mondiale, dove esiste l’ALA abbonda!!!! L’ALA dietetico è fondamentale per il mantenimento dei livelli tessutali di EPA e DHA e la sua carenza determina carenza degli omega 3 a catena lunga (EPA e DHA).
Ci sono tre destini fondamentali dell’ALA nel corpo umano: (A) l’ALA subisce la beta-ossidazione e fornisce energia, (B) l’ALA viene convertito in EPA e DHA in modo dipendente dal tessuto e (C) l’ALA viene immagazzinato nel tessuto adiposo e mobilitato come e quando richiesto. Vegani e vegetariani hanno una prevalenza simile di malattie neurologiche rispetto agli onnivori, suggerendo che qualsiasi alterazione del metabolismo cerebrale del DHA in questi individui non si manifesta neurologicamente.
Davis BC, Kris-Etherton PM. Achieving optimal essential fatty acid status in vegetarians: current knowledge and practical implications. Am J Clin Nutr. 2003;78(3):640S–6S.

Origine, fonti e utilizzo dei PUFA omega-3
Sia ALA (acido linolenico) che LA (Acido linoleico) costituiscono gli acidi grassi essenziali a 18 atomi di carbonio, precursori dell’acido eicosapentaenoico a 20 atomi di carbonio fisiologicamente potente (EPA; 20:5) e dell’acido arachidonico (AA; 20:4). La desaturazione e l’allungamento sia di LA (18:2) che di ALA (18:3) ai loro corrispondenti LC-PUFA, acido arachidonico (AA; 20:4) da LA ed EPA (20:5) e DHA (22:6 ) da ALA, sono eseguite dagli stessi insiemi di desaturasi ed elongasi comuni. Fortunatamente, questi enzimi hanno un’affinità 10 volte maggiore per ALA che per LA. Pertanto, l’assunzione di ALA invece di EPA e DHA preformati ha un ulteriore vantaggio di ridurre la conversione di LA in AA, che è responsabile della produzione di eicosanoidi infiammatori. Inoltre, un recente articolo fornisce prove che la conversione di ALA in DHA è sufficiente per mantenere i livelli di DHA nel cervello adulto].
Domenichiello AF, Kitson AP, Bazinet RP. Is docosahexaenoic acid synthesis from a-linolenic acid sufficient to supply the adult brain? Prog Lipid Res. 2015;59:54–66.
L’evidenza epidemiologica suggerisce benefici comparabili degli omega-3-PUFA di origine vegetale e marina.
Fleming JA, Kris-Etherton PM. The evidence for linolenic acid and cardiovascular disease benefits: comparisons with eicosapentaenoic acid and docosahexaenoic acid. Adv Nutr Int Rev J. 2014;5(6): 863S.
È chiaro da quanto detto sopra che i tre principali acidi grassi omega-3 disponibili da diverse fonti hanno effetti diversi sul metabolismo degli omega-3 negli esseri umani. Il pesce fornirebbe EPA e DHA, il cibo non vegetariano come il pollo fornisce ALA, EPA e DHA, e le alghe fornirebbero DHA o EPA, mentre i semi di lino, che sono materie prime di base promosse tramite FBC, forniscono solo ALA.
Sebbene non tutti gli acidi grassi omega-3 siano uguali, ciascuno di essi ALA, EPA e DHA sono tutti singolarmente bioattivi. Il DHA è considerato l’acido grasso omega-3 più potente e principale poiché è concentrato nel cervello e costituisce il 10-15% degli acidi grassi del cervello. È noto che il DHA dietetico sottoregola gli enzimi coinvolti nella sua stessa sintesi.
Nara TY, He WS, Tang C, Clarke SD, Nakamura MT. The E-box like sterol regulatory element mediates the suppression of human delta-6 desaturase gene by highly unsaturated fatty acids. Biochem Biophys Res Commun. 2002;296(1):111–7.
Alla luce di queste considerazioni, secondo cui la promozione di fonti di omega-3 non ittiche, come i semi di lino, potrebbe essere utile ai vegetariani, è stato presentato il concetto “Flax Bio-village” per ricavare omega-3 dai semi di lino e arricchire uova, latte, e pollo. I semi di lino sono una fonte di ALA, un omega-3-PUFA a catena più corta sarebbe l’ideale come fonte sostenibile, rinnovabile, economica e terrestre e riduce sostanzialmente l’impatto sui livelli dei pesci.
L’ALA è un acido grasso omega-3 essenziale, in quanto non può essere sintetizzato nel corpo umano. Le prove dei potenziali benefici degli omega-3 per la salute umana provengono in gran parte dagli acidi grassi omega-3 dei frutti di mare, in particolare EPA e DHA. Tuttavia, pochi studi hanno valutato l’acido grasso omega-3 di origine vegetale ALA.
Pan A, Chen M, Chowdhury R, Wu JH, Sun Q, Campos H, Mozaffarian D, Hu FB. a-Linolenic acid and risk of cardiovascular disease: a systematic review and meta-analysis. Am J Clin Nutr. 2012;96(6):1262–73.
Poiché EPA e DHA vengono rapidamente incorporati nei lipidi plasmatici e di membrana, l’efficacia di EPA e DHA è superiore a quella dell’ALA. Tuttavia, essendo l’ALA il principale acido grasso omega-3 essenziale, per l’effetto benefico a lungo termine, l’ALA potrebbe essere più importante nella nutrizione umana.
Simopoulos AP. Human requirement for N-3 polyunsaturated fatty acids. Poult Sci. 2000;79(7):961–70.
L’ALA è utile come candidato nutraceutico/farmaceutico ed è sicuro per l’uso come ingrediente alimentare .
Kim KB, Nam YA, Kim HS, Hayes AW, Lee BM. a-Linolenic acid: nutraceutical, pharmacological and toxicological evaluation. Food Chem Toxicol. 2014;70:163–78.
I dati sugli effetti benefici dell’ALA dei semi di lino non sono paragonabili ai dati sui pesci. Nove importanti studi hanno rivelato una relazione inversa tra i livelli di ALA e i disturbi cardiovascolari. I risultati sono convincenti in quanto la maggior parte di questi studi proviene da un ampio campione di popolazioni e/o da un periodo relativamente lungo.
Hu FB, Stampfer MJ, Manson JE, Rimm EB, Wolk A, Colditz GA, Hennekens CH, Willett WC. Dietary intake of alpha-linolenic acid and risk of fatal ischemic heart disease among women. Am J Clin Nutr. 1999;69(5):890–7.
Albert CM, Oh K, Whang W, Manson JE, Chae CU, Stampfer MJ, Willett WC, Hu FB. Dietary alpha-linolenic acid intake and risk of sudden cardiac death and coronary heart disease. Circulation. 2005;112(21):3232–8.
Erkkila AT, Lehto S, Pyorala K, Uusitupa MIJ. n-3 Fatty acids and 5-y risks of death and cardiovascular disease events in patients with coronary artery disease. J Clin Nutr. 2003;78:65–71.
Baylin A, Kabagambe EK, Ascherio A, Spiegelman D, Campos H. Adipose tissue alpha-linolenic acid and nonfatal acute myocardial infarction in Costa Rica. Circulation. 2003;107(12):1586–91.
Oda E, Hatada K, Katoh K, Kodama M, Nakamura Y, Aizawa Y. A case-control pilot study on n-3 polyunsaturated fatty acid as a negative risk factor for myocardial infarction. Int Heart J. 2005;46 (4):583–91.
Djoussé L, Arnett DK, Carr JJ, Eckfeldt JH, Hopkins PN, Province MA, Ellison RC. Investigators of the NHLBI FHS. Dietary linolenic acid is inversely associated with calcified atherosclerotic plaque in the coronary arteries: the National Heart, Lung, and Blood Institute Family Heart Study. Circulation. 2005;111(22):2921–6
Djoussé L, Pankow JS, Eckfeldt JH, Folsom AR, Hopkins PN, Province MA, Hong Y, Ellison RC. Relation between dietary linolenic acid and coronary artery disease in the National Heart, Lung, and Blood Institute Family Heart Study. Am J Clin Nutr. 2001;74:612–9.
Rodriguez-Leyva D, Bassett CMC, McCullough R, Pierce GN. The cardiovascular effects of flaxseed and its omega-3 fatty acid, alpha-linolenic acid. Can J Cardiol. 2010;26:489–496.
Ascherio A, Rimm EB, Giovannucci EL, Spiegelman D, Stampfer M, Willett WC. Dietary fat and risk of coronary heart disease in men: cohort follow up study in the United States. BMJ. 1996;313(7049):84–90.
Tuttavia, i semi di lino crudi possono agire come antinutrienti, in quanto possono interferire nello sviluppo postnatale.
Thomas FX, Robert LS, Black TN, Olejnik N, Wiesenfeld TW, Babu UB, Bryant M, Flynn TJ, Ruggles DI. Effects of flaxseed and defatted flaxseed meal on reproduction and development in rats. Food Chem Toxicol. 2003;41:819–34.
Gli acidi grassi Omega-3, essendo acidi grassi polinsaturi, sono molto instabili e devono essere stabilizzati per avere una migliore durata di conservazione.
L’indice di omega-3 (% di EPA + DHA negli acidi grassi totali dei globuli rossi) continua ad accumulare credito come fattore di rischio primario, superando in affidabilità il punteggio di Framingham correlato ai fattori di rischio storici, per valutare malattie cardiovascolari e cerebrovascolari.
Il modello genetico dell’Homo sapiens si è evoluto su una dieta che era fondamentalmente bilanciata nei grassi essenziali (Omega-6/3 ~ 1).
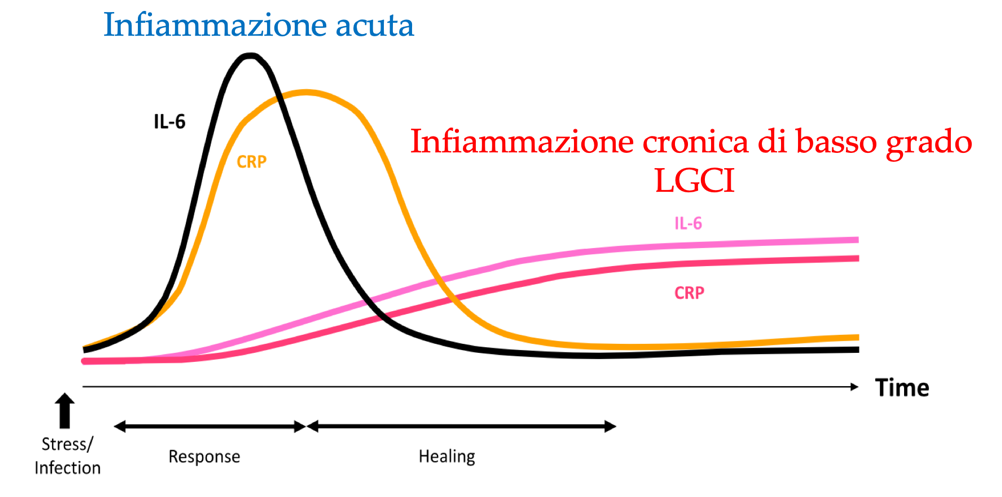
Agendo sul rapporto omega 6:3, si condiziona il rapporto tra derivati pro e anti infiammatori, con la possibilità di smorzare le risposte infiammatorie esagerate e contrastare la low grade chronic inflammation.